Inligting oor gesondheidsorg
Sommige ouer diabete ondervind slaapstoornis, en gevolglik moet hulle slaappille selekteer. Besprekings ontstaan oor die gebruik van Melaxen vir tipe 1 en tipe 2-diabetes.
In die gebruiksaanwysings van hierdie middel is een van die kontraindikasies die kwaal. Daar word geglo dat Melaxen bloedglukose kan verlaag of verhoog. Maar sommige diabete neem hierdie slaappil en kla nie oor die toestand van hipo- of hiperglukemie nie. Wat gebeur eintlik in die liggaam van 'n diabeet na die gebruik van die middel?
Menings verskil oor hierdie middel. Maar tog, met verwysing na die resultate van herhaalde studies, kan ons die gevolgtrekking maak dat die middel Melaxen ten minste nie 'n negatiewe invloed op die menslike liggaam met tipe 1 of tipe 2-diabetes het nie. Die aktiewe bestanddeel, melatonien, is 'n belangrike hormoon wat baie prosesse in die menslike liggaam reguleer, veral bioritmes.
Daarom is dit die beste om u dokter te raadpleeg voordat u slaappille gebruik. Hy sal beslis die haalbaarheid van die gebruik van die middel kan beoordeel en die regte dosis kan voorskryf.
Inligting oor die dwelm Melaxen
Die middel word gebruik vir slaapstoornis en as adaptogeen om die bioritme te stabiliseer, byvoorbeeld tydens reis. Melaxen word in die vorm van tablette geproduseer wat elk melatonien (3 mg) bevat, asook aanvullende komponente: magnesiumstearaat, mikrokristallyne sellulose, kalsiumwaterstoffosfaat, skilferkol, talk en isopropanol.
Melatonien is die belangrikste hormoon in die pituïtêre klier en die reguleerder van sirkadiese ritmes. Melatonien verrig tydens die ontwikkeling of gebruik daarvan as medisyne sulke funksies in die menslike liggaam:
- verminder fisiese, geestelike en emosionele spanning,
- beïnvloed die endokriene stelsel (verhinder veral die afskeiding van gonadotropiene),
- normaliseer bloeddruk en slaapfrekwensie,
- verhoog die produksie van antiliggame,
- is tot 'n mate 'n antioksidant,
- beïnvloed aanpassing tydens skielike veranderinge in klimaat en tydsones,
- reguleer die spysvertering en breinfunksie,
- vertraag die verouderingsproses en nog baie meer.
Die gebruik van die middel Melaxen mag nie net weens tipe 1 en tipe 2-diabetes verbied word nie, maar ook as gevolg van ander kontraindikasies:
- individuele onverdraagsaamheid teenoor die komponente,
- swangerskap en laktasie,
- verswakte nierfunksie en chroniese nierversaking,
- outo-immuun patologieë,
- epilepsie (neurologiese siekte),
- myeloom ('n kwaadaardige gewas wat gevorm word uit bloedplasma),
- limfoganulomatose (kwaadaardige patologie van limfoïede weefsel),
- limfoom (geswelde limfknope),
- leukemie (kwaadaardige siektes van die hematopoietiese stelsel),
- allergie.
In sommige gevalle kan die middel om een of ander rede negatiewe gevolge veroorsaak, soos:
- oggend slaperigheid en hoofpyn,
- spysverteringskanaal (naarheid, braking, diarree)
- allergiese reaksies (swelling).
Melaxen kan sonder 'n doktersvoorskrif by die apteek gekoop word. Op die farmakologiese mark van Rusland is daar ook die analoë daarvan: Melarena, Circadin, Melarithm.
Maar die konsultasie van die dokter sal nie oorbodig wees nie, veral nie as 'n gewone persoon of 'n diabeet aan enige ander siektes ly nie.
Oorwegings
As u diabetes het wat dit oorweeg om melatonien te neem, raadpleeg u dokter om vas te stel of daar moontlike komplikasies is wat u moet monitor. U dokter sal u tipe diabetes, mediese geskiedenis en ander faktore oorweeg om 'n aanbeveling te maak. Die American Diabetes Association dui aan dat newe-effekte, effektiwiteit, dwelminteraksies en die regte doseringsinligting vir hierdie tipe medisyne en aanvullings nie altyd goed verstaan word nie, dus is dit die beste om na alternatiewe behandelings vir u slaapprobleme te kyk.
Hoe werk die hormoon melatonien?

Melatonien is die belangrikste pituïtêre hormoon wat hoofsaaklik in die pineaalklier geproduseer word. Die produksie daarvan word veroorsaak deur die blootstelling aan lig aan die retina. Dit dui dus die tyd van die dag aan, en dit reguleer die sirkadiese ritmes. Dit beïnvloed ook die sikliese skommelinge in die intensiteit van die prosesse van verskillende organe en weefsels in die liggaam, wat die sirkadiese ritme verander.
Die bestuur van sirkadiese ritme op verskillende vlakke, insluitend ß-selle, is inderdaad betrokke by metaboliese beheer, sowel as by die ontwikkeling van tipe 2-diabetes. Die hormoon stuur seine op sellulêre vlak met behulp van twee reseptore: (MT1) en (MT2). Albei reseptore werk hoofsaaklik deur die Gαi-proteïen, en verlaag die vlak van cAMP deur die remming van G (G I) proteïene, maar ander seinweë word ook gebruik. Pleiotropisme op die vlak van beide reseptore en 'n sekondêre seinapparaat. Dit verklaar waarom die gemelde effekte op die vrystelling van insulien nie 'n duidelike begrip van die regulatoriese rol van melatonien in insulienafskeiding gelewer het nie. Daar is dus berig dat die remmende en stimulerende effekte van hierdie hormoon die insulienafskeiding beïnvloed.
Studies het getoon:
Teen hierdie agtergrond het ons gevind dat die MTNR1B (MT2) geen verband hou met verhoogde plasmaglukosevlakke. 'N Afname in die vroeë insulienrespons met intraveneuse glukose toediening, 'n vinnige agteruitgang in insulienafskeiding met verloop van tyd, en 'n verhoogde risiko om in die toekoms tipe 2-diabetes te ontwikkel. Ten spyte van 'n baie hoë vlak van genetiese skakeling, is daar nog nie 'n molekulêre begrip van die rede waarom melatonien seine betrokke is by die patogenese van tipe 2-diabetes nie.
Om hierdie probleem op te los, het ons eksperimentele studies gedoen op die gebied van menslike ß-muise en muise, sowel as kliniese studies by mense. Dit blyk dat risikovariant 10830963 van MTNR1B 'n uitdrukking is van kwantitatiewe eienskappe (eQTL) wat 'n verhoogde uitdrukking van MTNR1B mRNA in menslike eilande lewer. Eksperimente in INS-1 832/13 ß-selle en MT2 van eksperimentele muise (Mt2 - / -) het gevind dat die remming van die hormoon melatonien die sein van insulienvrystelling direk beïnvloed.
Menslike studies toon dat melatonienbehandeling insulienafskeiding in alle pasiënte belemmer. Maar die draers van die risikogene is meer sensitief vir hierdie remmende effek. Gesamentlik ondersteun hierdie waarnemings 'n model waarin 'n geneties bepaalde toename in melatonien-seine insulienafskeiding onderlê. Versteurde wat patologiese tekens van tipe 2-diabetes behels.
Samevatting van 'n wetenskaplike artikel oor medisyne en gesondheidsorg, skrywer van 'n wetenskaplike artikel - Konenkov Vladimir Iosifovich, Klimontov Vadim Valerievich, Michurina Svetlana Viktorovna, Prudnikova Marina Alekseevna, Ishenko Irina Yurievna
Die hormoon van die pineaalklier melatonien verseker die sinchronisasie van insulienafskeiding en glukose homeostase met wisselende ligte en donker tyd van die dag. Oortreding van die alliansie tussen melatonien-gemedieerde sirkadiese ritmes en insulienafskeiding word waargeneem by tipe 1 en tipe 2 diabetes mellitus (T1DM) en T2DM. Insulientekort in tipe 1-diabetes gaan gepaard met 'n toename in die produksie van melatonien in die pineaalklier. In teenstelling hiermee word T2DM gekenmerk deur 'n afname in melatonien-sekresie. In genoomwye studies word variante van die melatonien MT2-reseptorgene (rs1387153 en rs10830963) geassosieer met vastende glukemie, ß-selfunksie en tipe 2-diabetes. Melatonien verhoog die proliferasie van ß-selle en neogenese, verbeter insulien sensitiwiteit en verminder oksidatiewe spanning in die retina en niere in eksperimentele diabetesmodelle. Verdere studies is nodig om die terapeutiese waarde van hierdie hormoon by pasiënte met diabetes te evalueer.
Melatonien en diabetes: van patofisiologie tot die behandelingsperspektiewe
Pineale hormoon melatonien sinchroniseer insulienafskeiding en glukose homeostase met sonperiodes. Wanverhouding tussen melatonium-gemiddelde sirkadiese ritmes en insulienafskeiding kenmerk diabetes mellitus tipe 1 (T1DM) en tipe 2 (T2DM). Insulientekort in T1DM gaan gepaard met verhoogde melatonienproduksie. Omgekeerd word T2DM gekenmerk deur verminderde melatonien-sekresie. In genoomwye assosiasiestudies is die variante van die melatonienreseptor MT2 geen (rs1387153 en rs10830963) geassosieer met vastende glukose, beta-selfunksie en T2DM. In eksperimentele modelle van diabetes verhoog melatonien beta-selproliferasie en neogenese, verbeter insulienweerstandigheid en verlig oksidatiewe spanning in retina en niere. Verdere ondersoek is egter nodig om die terapeutiese waarde van melatonien by diabetiese pasiënte te bepaal.
Die teks van die wetenskaplike werk oor die tema "Melatonin in diabetes mellitus: van patofisiologie tot behandelingsperspektiewe"
Melatonien in diabetes: van patofisiologie tot vooruitsigte vir behandeling
Konenkov V.I., Klimontov V.V., Michurina S.V., Prudnikova M.A., Ischenko I.Yu.
Navorsingsinstituut vir kliniese en eksperimentele limfologie, Novosibirsk
(Direkteur - Akademikus RAMNV.I. Konenkov)
Die hormoon van die pineaalklier melatonien verseker die sinchronisasie van insulienafskeiding en glukose homeostase met wisselende ligte en donker tyd van die dag. Oortreding van die alliansie tussen melatonien-gemedieerde sirkadiese ritmes en insulienafskeiding word waargeneem by tipe 1 en tipe 2 diabetes mellitus (T1DM) en T2DM. Insulientekort in tipe 1-diabetes gaan gepaard met 'n toename in die produksie van melatonien in die pineaalklier. In teenstelling hiermee word T2DM gekenmerk deur 'n afname in melatonien-sekresie. In vol genomiese studies word variante van die melatonien MT2-reseptor geen (rs1387153 en rs10830963) geassosieer met vastende glukemie, funksie (i-selle en CD2. Melatonien verhoog proliferasie en neogenese (i-selle, verbeter insulien sensitiwiteit en verminder oksidatiewe spanning in die retina en niere in die niere) eksperimentele modelle van diabetes Om die terapeutiese waarde van hierdie hormoon by pasiënte met diabetes te evalueer, is verdere studies nodig.
Sleutelwoorde: diabetes mellitus, melatonien, sirkadiese ritmes, insulien, pineaalklier
Melatonien en diabetes: van patofisiologie tot die behandelingsperspektiewe
Konenkov V.I., Klimontov V.V., Michurina S.V., Prudnikova M.A., Ishenko I.Ju.
Navorsingsinstituut vir kliniese en eksperimentele limfologie, Novosibirsk, Russiese Federasie
Pineale hormoon melatonien sinchroniseer insulienafskeiding en glukose homeostase met sonperiodes. Wanverhouding tussen melatonien-gemedieerde sirkadiese ritmes en insulienafskeiding kenmerk diabetes mellitus tipe 1 (T1DM) en tipe 2 (T2DM). Insulientekort in T1DM gaan gepaard met verhoogde melatonienproduksie. Omgekeerd word T2DM gekenmerk deur verminderde melatonien-sekresie. In genoomwye assosiasiestudies is die variante van die melatonienreseptor MT2 geen (rs1387153 en rs10830963) geassosieer met vastende glukose, beta-selfunksie en T2DM. In eksperimentele modelle van diabetes verhoog melatonien beta-selproliferasie en neogenese, verbeter insulienweerstandigheid en verlig oksidatiewe spanning in retina en niere. Verdere ondersoek is egter nodig om die terapeutiese waarde van melatonien by diabetiese pasiënte te bepaal.
Sleutelwoorde: diabetes, melatonien, sirkadiese ritmes, insulien, epifise
Bioritmes van die endokriene stelsel, sowel as hul veranderinge in die patologie-toestande, trek al die dekades die aandag van navorsers. Die oogmerk van besondere belangstelling in die bestudering van diabetes mellitus (DM) vanuit die perspektief van chronomedisien is die pineaalklierhormoon melatonien. Hierdie hormoon speel 'n leidende rol in die sinchronisasie van hormonale stimuli en metaboliese prosesse met die afwisseling van lig en donker. In onlangse jare is fundamenteel nuwe inligting verkry oor die rol van melatonien in die regulering van insulinsekresie en die patofisiologie van koolhidraatmetabolismestoornisse, en die vooruitsigte vir die gebruik van melatonien vir die behandeling van diabetes word bespreek. Die veralgemening van hierdie inligting was die doel van hierdie oorsig.
Sekresie en basiese fisiologiese effekte van melatonien
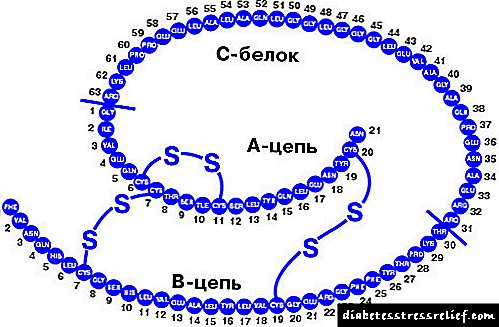
Die hormoon melatonien is in 1958 geïsoleer van materiaal van die bees van die pineale klier. Melatonien word gevorm uit L-tryptofaan deur serotonien met die deelname van arylalkylamien-asetieltransferase (AA-NAT, 'n belangrike reguleringsensiem) en hydroxyindole-O-metyltransferase. By 'n volwassene word ongeveer 30 mcg per dag gesintetiseer
melatonien, is die konsentrasie daarvan in die bloedserum snags 20 keer groter as gedurende die dag. Die sirkadiese ritme van melatonien-sintese word beheer deur die suprachiasmatiese kern (SCN) van die hipotalamus. Met inligting oor die beligtingverandering vanaf die retina, stuur SCN seine deur die superieur servikale ganglion en norarenergiese vesels na die pineaalklier. Aktivering van epifiseale ß1-adrenergiese reseptore inhibeer die splitsing van AA-NAT en verhoog die sintese van melatonien.
Benewens die pineaalklier, is melatonienproduksie gevind in neuro-endokriene selle van die retina, enterochromaffienselle van die spysverteringskanaal (EC-selle), selle in die lugweë, timus, byniere, paraganglia, pankreas en ander soorte selle wat verband hou met die diffuse neuro-endokriene stelsel. Witbloedselle, bloedplaatjies, endoteliocyte, nierbarkenselle en ander nie-endokriene selle kan ook melatonien produseer. Die belangrikste bron van die sirkulerende melatonien is die pineaalklier. Die ritmes van melatonien-afskeiding, wat saamval met die ritme van lig-duisternis, is slegs kenmerkend van die pineaalklier en retina.
Die fisiologiese effekte van melatonien word bemiddel deur membraan- en kernreseptore. By die persoon
eeu het 2 soorte reseptore vir melatonien gevind: MT1 (MTNR1A) en MT2 (MTNR1B). MT2-reseptore kom voor in die retina, in verskillende dele van die brein, en daar word geglo dat dit deur die sirkadiese ritmes gevestig word. Die belangrikste funksie van melatonien is om fisiologiese en metaboliese prosesse met die daaglikse en seisoenale ritmes 5, 6 te sinchroniseer. In die besonder beïnvloed die afskeiding van melatonien die ritmes van die kardiovaskulêre, immuun- en endokriene stelsels.
Die effek van melatonien op insulienafskeiding en glukose homeostase
Die oënskynlike nie-ooreenstemming van die ritmes van die sirkadiese afskeiding van melatonien en insulien hou verband met verskille in die biologiese funksies van hierdie hormone. In teenstelling met melatonien, word die minimum insulienvlak by mense snags waargeneem, aangesien die hooffunksie van insulien - die beheer van metabolisme in die voedingstyd nie snags moet realiseer nie. Daar is aangetoon dat 'n skending van die normale alliansie tussen voedsel en die tyd van die dag met 'n verskuiwing van normale maaltye met 12 uur gepaard gaan met 'n toename in insulienproduksie by vrywilligers. Melatonien verseker die sinkronisasie van metaboliese prosesse met die nagperiode, d.w.s. tyd wat deur 'n persoon geprogrammeer word vir vas, en dit kan 'n remmende effek op die insulienafskeiding hê.
Die feit van die uitdrukking van MT-1- en MT-2-melatonienreseptore in pankreas-eilandjies by rotte en muise is vasgestel. Op menslike eilandjies word MT1 en, in 'n mindere mate, MT2-reseptore 12, 13. uitgedruk. Die uitdrukking van M ^-reseptore is veral kenmerkend van a-selle 11, 12, MT2-reseptore word in p-selle 11, 13, 14. gevind. vitro demonstreer die remmende effek van melatonien op insulienafskeiding in p-selle, muisinsulomoselle (MIN-6) en rotte (INS-1). In 'n holistiese organisme is die effek van melatonien egter nie so duidelik nie. Daar is bewys dat melatonien die afskeiding van beide glukagon en insulien in geperforeerde menslike eilandjies stimuleer. Daar is berig dat melatonien geen effek op insulienafskeiding by eilande van ob / ob-muise gehad het nie (vetsugmodel en tipe 2-diabetes (tipe 2-diabetes)). Die dubbelsinnigheid van die effek van melatonien word blykbaar verklaar deur die verskeidenheid seinweë waardeur die effekte daarvan bemiddel word. Die remmende effek van melatonien op insulienproduksie hou verband met die remming van cAMP- en cGMP-afhanklike weë, en die stimulerende effek word bemiddel deur 0 (d) -proteïene, fosfolipase C en IP.
Veranderings in insulienafskeiding en glukose-homeostase is gevind by diere met die verwyderde pineaalklier. Daar is aangetoon dat pinealektomie by rotte lei tot insulienweerstandigheid in die lewer, aktivering van glukoneogenese en 'n toename in glukemie snags. Verhoogde glukose-gestimuleerde afskeiding van insulien en
Diabetes mellitus. 2013, (2): 11-16
die toename in die amplitude van sy ritmes is opgespoor in gekweekte binneselle van rotte wat aan pinealektomie onderworpe is. Die verwydering van die pineaalklier by rotte met die T2DM-model (OLETF-lyn) lei tot hiperinsulinemie en die ophoping van trigliseriede in die lewer. Daar word voorgestel dat melatonien in die moeder sirkadiese ritmes van energiemetabolisme in die voorgeboortelike periode kan programmeer. In die nageslag van muise wat aan pinealektomie onderworpe is, het 'n afname in glukosestimuleerde insulienafskeiding, insulienweerstandigheid van die lewer en gevolglik 'n verminderde glukosetoleransie aan die einde van die daglig geopenbaar.
In pasiënte met arteriële hipertensie word 'n afname in die snagsekresie van melatonien geassosieer met 'n toename in vastende insulienvlakke en met die HOMA-insulienweerstandigheidsindeks.
Dit lyk dus waarskynlik dat melatonien bydra tot die skepping van die mees optimale modus van energiemetabolisme in toestande van lae sekresie en 'n hoë sensitiwiteit vir insulien in die nag.
Melatonienreseptor geen polimorfisme en suikersiekte
Die resultate van molekulêre genetiese studies het getoon dat daar 'n verband bestaan tussen polimorfe variante van die melatonienreseptore en die ontwikkeling van tipe 2-diabetes. Twee variante van die enkele nukleotied-polimorfisme van die MT2-geen (MTYB.1B): gb1387153 en gb10830963 word geassosieer met vastende glukemie, insulienafskeiding en T2DM in Europese bevolkings. Daar is vasgestel dat die teenwoordigheid van die T-alleel van locus GB 13 8 715 3 geassosieer word met die vas van plasmaglukose (B = 0,06 mmol / L) en die risiko om hiperglykemie of T2DM te ontwikkel (0H = 1.2). 'N Analise van tien genoomwye studies dui daarop dat die teenwoordigheid van elke G-allel van die gb10830963-lokus van die MTYB.1B-geen geassosieer word met 'n toename in vas glukemie met 0,07 mmol / L, sowel as met 'n afname in die funksie van die b-sel, geskat deur die HOMA-B-indeks. 'N Metaanalise van 13 studies met 'n geval-kontrole-ontwerp het getoon dat die teenwoordigheid van die G-allel op hierdie lokus die risiko verhoog om T2DM te ontwikkel (0H = 1.09).
Die MTYB.1B-geen kan dus beskou word as 'n nuwe lokus van 'n genetiese geneigdheid tot T2DM. Die mate van invloed van die MTIV.1B-geen op die risiko om die siekte te ontwikkel, is redelik beskeie, maar dit is redelik vergelykbaar met die effek van ander "diabetogene" gene. Die kombinasies van genetiese eienskappe, wat MTIV.1B en ander gene geassosieer met die vastende glukose, is nouer gekoppel aan die risiko van diabetes: OSK, OKKYA, O6RS2 25, 26.
Veranderings in die afskeiding van melatonien by diabetes
Stoornisse van melatonien-afskeiding is gevind by veroudering en 'n aantal siektes by die mens, waaronder seisoenale affektiewe en bipolêre versteurings.
Diabetes mellitus. 2013, (2): 11-16
stv, demensie, slaapstoornisse, pynsindrome, kwaadaardige neoplasmas. Komplekse veranderinge in die afskeiding van melatonien word gekenmerk deur diabetes. In modelle van T1DM by diere word 'n toename in die vlak van melatonien in die bloed getoon, sowel as 'n toename in die uitdrukking van die regulerende ensiem AA-NAT in die pineaalklier 17, 27, 28. In die pineaalkliere van diere met absolute insuliengebrek, die uitdrukking van insulienreseptore, B1-adrenoreceptors, en sirkadiese PER1-gene. en BMAL1. Die invoering van insulien in hierdie model van diabetes help om die vlak van melatonien in die bloed en geenuitdrukking in die pineaalklier te normaliseer.
Ander veranderinge in die produksie van melatonien is in T2DM gevind. In Goto Kakizaki-rotte (genetiese model van T2DM), is 'n afname in insulienreseptoruitdrukking en AA-NAT-aktiwiteit in die pineaalklier gevind. Pasiënte met tipe 2-diabetes het 'n verlaagde vlak van melatonien in die bloed. Ondersoeke met bloedmonsters per uur het 'n skerp afname in die naguitskeiding van melatonien by mans met tipe 2-diabetes getoon. By pasiënte met metaboliese sindroom is oortredings van melatonien-sekresie geopenbaar, wat gemanifesteer word deur die afwesigheid van fisiologiese verhogings in die uitskeiding van die metaboliet van melatonien 6-hidroksimelatoninsulfaat (6-COMT) met urine. In teenstelling hiermee het ander outeurs hiperexkresie van 6-COMT geopenbaar by pasiënte met metaboliese sindroom. Die verhouding melatonien / insulien in bloedplasma wat 3 uur in die nag geneem is by pasiënte met metaboliese sindroom, is verminder. Die verskil in die nag- en dagkonsentrasies van melatonien was omgekeerd gekorreleer met vas glukemie.
Daar is nie veel bekend oor veranderinge in die ekstrapineale produksie van melatonien by diabetes nie. Daar is aangetoon dat by rotte met streptozotocin-diabetes, die vlak van melatonien en die aktiwiteit van AA-NAT in die retina verminder word, en die toediening van insulien elimineer hierdie afwykings. Veranderings in die sintese van melatonien in die retina in diabetiese retinopatie is nie bestudeer nie. Plasma melatonienkonsentrasie by pasiënte met tipe 2-diabetes met proliferatiewe diabetiese retinopatie was aansienlik laer as in pasiënte sonder hierdie komplikasie.
Die belangrikste soorte diabetes word dus gekenmerk deur multidirektiewe veranderinge in die afskeiding van melatonien in die pineaalklier en die konsentrasie van melatonien in die bloed. In beide soorte diabetes word 'n omgekeerde verband gevind tussen die produksie van insulien en melatonien, wat daarop dui dat daar wederkerige verwantskappe tussen hierdie hormone is.
Vooruitsigte vir die gebruik van melatonien in diabetes
Die effek van melatonien op die ontwikkeling van tipe 1-diabetes is in eksperimente bestudeer. Melatonien verhoog die verspreiding van b-selle en bloedinsulienvlakke by rotte met streptozotocin-diabetes. Benewens die verspreiding van p-selle stimuleer, remmel melatonien hul apoptose en stimuleer dit ook die vorming van nuwe
eilandjies van die buisepiteel van die pankreas. In die model van diabetes mellitus wat in die neonatale periode deur streptozotocien by rotte veroorsaak is, het melatonien geen insulienafskeiding beïnvloed nie, maar die insulien sensitiwiteit verhoog en die glukemie verminder. Die beskermende effek van melatonien op b-selle kan, ten minste gedeeltelik, toegeskryf word aan die antioksidant en immuunmodulerende effekte. Daar is bewys dat melatonien by diere met diabetes 'n duidelike antioksidant-effek het en dit help om die versteurde balans van antioksidante te herstel. Die inhiberende effek van melatonien op Th1-limfosiete verdubbel die leeftyd van oorgeplante eilandjies in NOD-muise.
Die gebruik van melatonien in die CD2-model en die metaboliese sindroom (Zucker-rotte) het gepaard gegaan met 'n afname in vastende glukemie, geslikte hemoglobien (HbA1c), vrye vetsure, insulien, die insulienweerstandigheidsindeks (HOMA-IR) en die konsentrasie van pro-inflammatoriese sitokiene in die bloed. Daarbenewens het melatonien die leptienvlakke verlaag en die adiponektienvlakke verhoog. Hierdie gegewens dui daarop dat melatonien 'n gunstige effek op vetweefselfunksie, chroniese inflammasie, insulienensitiwiteit, koolhidraat- en vetmetabolisme 40, 41. Melatonien dra by tot die gewigsverlies in diere-modelle van vetsug. Volgens nie-gerandomiseerde studies gaan die neem van melatonien by pasiënte met metaboliese sindroom gepaard met 'n afname in bloeddruk, merkers van oksidatiewe stres, HOMA-IR en cholesterolvlakke. Die toediening van langwerkende melatonien vir die behandeling van slapeloosheid by pasiënte met tipe 2-suikersiekte het nie die vlak van insulien en C-peptied beïnvloed nie en het gepaard gegaan met 'n beduidende afname in HbA1c na 5 maande. terapie.
Daar is bewyse van die effek van melatonien op die ontwikkeling van vaskulêre komplikasies van diabetes. Melatonien voorkom die aktivering van lipiedperoksidasieprosesse in die retina 45, 46, verbeter die elektrofisiologiese eienskappe en verminder die produksie van vaskulêre endoteliale groeifaktor (VEGF) in die retina onder hiperglikemie. Toediening van melatonien aan rotte met streptozotocin-diabetes verhoed die uitskeiding van albumien 47, 48 van die urien. Dit verhoog melatonien oksidatiewe spanning in die niere van diere met diabetes, en belemmer die sintese van fibrogeen faktore: TGF-r, fibronektien. Onder toestande van oksidatiewe spanning en inflammasie het die hormoon 'n beskermende effek op die endoteel. Melatonien herstel endotheel-afhanklike aorta dilatasie, wat verswak is by hiperglikemie. Die antioksidant-effek van melatonien in die beenmurg gaan gepaard met 'n toename in die vlak van endotheel voorloperselle in rotte by rotte met streptozotocin-diabetes. Hierdie gegewens is ongetwyfeld van belang, aangesien diabetes gekenmerk word deur verswakte mobilisering van hierdie selle vanaf die beenmurg.
In pasiënte met tipe 1-diabetes verhoog melatonien die mate van die daling in die nag in diastoliese bloeddruk. Laasgenoemde effek kan 'n gunstige waarde in diabetiese outonome neuropatie hê wat verband hou met 'n afname in die mate van fisiologiese afname in bloeddruk snags.
Die voorgestelde gegewens dui op die sleutelrol van melatonien in die regulering van die sirkadiese ritmes van sekresie
Diabetes mellitus. 2013, (2): 11-16
insulien en glukose homeostase. Vir diabetes is skending van die sirkadiese produksie van melatonien in die pineaalklier en die konsentrasie van melatonien in die bloed kenmerkend. Eksperimentele gegewens dui daarop dat melatonien ß-sel disfunksie kan verminder, die ontwikkeling van diabetes en die komplikasies daarvan kan vertraag. Die patofisiologiese rol van afwykings in die afskeiding van melatonien by diabetes en die moontlikheid van terapeutiese gebruik van hierdie hormoon verdien verdere navorsing.
1. Borjigin J, Zhang LS, Calinescu AA. Sirkadiese regulering van ritmiteit van die pineaalklier. Mol Cell Endocrinol. 2012,349 (1): 13-9.
2. Simonneaux V, Ribelayga C. Generasie van die melatonien-endokriene boodskap by soogdiere: 'n oorsig van die ingewikkelde regulering van melatoniensintese deur norepinefrien, peptiede en ander pineale transmitters. Pharmacol Rev. 2003.55 (2): 325-95.
3. Hardeland R. Neurobiologie, patofisiologie en behandeling van melatonientekort en disfunksie. Scientific World Journal 2012: 640389.
4. Slominski RM, Reiter RJ, Schlabritz-Loutsevitch N, Ostrom RS, Slominski AT. Melatonienmembraanreseptore in perifere weefsels: verspreiding en funksies. Mol Cell Endocrinol. 2012.351 (2): 152-66.
5. Anisimov V.N. Epifise, bioritmes en veroudering. Vooruitgang in Fisiologiese Wetenskappe 2008.39 (4): 40-65.
6. Arushanyan E.B., Popov A.V. Moderne idees oor die rol van suprachiasmatiese kerne van die hipotalamus in die organisering van die daaglikse periodisme van fisiologiese funksies. Vooruitgang in Fisiologiese Wetenskappe 2011.42 (4): 39-58.
7. Borodin Yu.I., Trufakin V.A., Michurina S.V., Shurly-gina A.V. Strukturele en tydelike organisasie van die lewer-, limfatiese, immuun-, endokriene stelsels in stryd met die ligte regime en die bekendstelling van melatonien. Novosibirsk: Manuscript Publishing House, 2012: 208.
8. Scheer FA, Hilton MF, Mantzoros CS, Shea SA. Nadelige metaboliese en kardiovaskulêre gevolge van verkeerde belyning van die dyk. Proc Natl Acad Sci VSA 2009.106 (11): 4453-8.
9. Bailey CJ, Atkins TW, Matty AJ. Melatonieninhibisie van insulienafskeiding in die rat en muis. Horm Res. 1974.5 (1): 21-8.
10. Muhlbauer E, Peschke E. Bewyse vir die uitdrukking van beide die MT1- en boonop die MT2-melatonienreseptor, in die rotspankreas, eiland en beta-sel. J Pineal Res. 2007.42 (1): 105-6.
11. Nagorny CL, Sathanoori R, Voss U, Mulder H, Wierup N. Verspreiding van melatonienreseptore in muriene pankreas-eilandjies. J Pineal Res. 2011.50 (4): 412-7.
12. Ramracheya RD, Muller DS, Squires PE, Brereton H, Sugden D, Huang GC, Amiel SA, Jones PM, Persaud SJ. Funksie en uitdrukking van melatonienreseptore op menslike pankreas-eilandjies. J Pineal Res. 2008.44 (3): 273-9.
13. Lyssenko V, Nagorny CL, Erdos MR, Wierup N, Jonsson A, Spegel P, Bugliani M, Saxena R, Fex M, Pulizzi N, Isomaa B, Tuomi T, Nilsson P, Kuusisto J, Tuomilehto J, Boehnke M, Altshuler D, Sundler F, Eriksson JG, Jackson AU, Laakso M, Marchetti P, Watanabe RM, Mulder H, Groop L. Algemene variant in MTNR1B wat verband hou met 'n verhoogde risiko van tipe 2-diabetes en verswakte vroeë insulienafskeiding. Nat Genet. 2009.41 (1): 82-8.
14. Bouatia-Naji N, Bonnefond A, Cavalcanti-Proenga C, Spars0 T, Holmkvist J, Marchand M, Delplanque J, Lobbens S, Roche-leau G, Durand E, De Graeve F, Chevre JC, Borch-Johnsen K, Hartikainen AL, Ruokonen A, Tichet J, Marre M, Weill J.,
Heude B, Tauber M, Lemaire K, Schuit F, Elliott P, J0rgensen T, Charpentier G, Hadjadj S, Cauchi S, Vaxillaire M, Sladek R, Visvikis-Siest S, Balkau B, Levy-Marchal C, Pattou F, Meyre D, Blakemore AI, Jarvelin MR, Walley AJ, Hansen T, Dina C, Pedersen O, Froguel P. 'n Variant naby MTNR1B hou verband met 'n verhoogde vastende plasmaglukosevlak en tipe 2-diabetesrisiko. Nat Genet. 2009.41 (1): 89-94.
15. Muhlbauer E, Albrecht E, Hofmann K, Bazwinsky-Wutschke I, Peschke E. Melatonin inhibeer insulienafskeiding in rot insulinoom P-selle (INS-1) wat die menslike melatonienreseptor isoform MT2 heteroloog uitdruk. J Pineal Res. 2011.51 (3): 361-72.
16. Frankel BJ, Strandberg MJ. Insulienvrystelling van geïsoleerde muis-eilandjies in vitro: geen effek van fisiologiese vlakke van melatonien of arginien vasotosien nie. J Pineal Res. 1991.11 (3-4): 145-8.
17. Peschke E, Wolgast S, Bazwinsky I, Prnicke K, Muhlbauer E. Verhoogde melatonien-sintese in pineaalkliere van rotte in strep-tozotocin-geïnduseerde tipe 1-diabetes. J Pineal Res. 2008.45 (4): 439-48.
18. Nogueira TC, Lellis-Santos C, Jesus DS, Taneda M, Rodrigues SC, Amaral FG, Lopes AM, Cipolla-Neto J, Bordin S, Anhe GF. Die afwesigheid van melatonien veroorsaak 'n weerstand teen insulienweerstand in die lewer en verhoogde glukoneogenese as gevolg van die stimulering van die nagevolle proteïenrespons. Endokrinologie 2011,152 (4): 1253-63.
19. la Fleur SE, Kalsbeek A, Wortel J, van der Vliet J, Buijs RM. Rol van die pineaal en melatonien in glukose-homeostase: pinealec-tomy verhoog die glukosekonsentrasie van die nag. J Neuroendo-crinol. 2001.13 (12): 1025-32.
20. Picinato MC, Haber EP, Carpinelli AR, Cipolla-Neto J.
Daaglikse ritme van glukose-geïnduseerde insulienafskeiding deur geïsoleerde eilandjies van ongeskonde en pinealektomiseerde rotte. J Pineal Res. 2002.33 (3): 172-7.
21. Nishida S, Sato R, Murai I, Nakagawa S. Effek van pinealektomie op plasmavlakke van insulien en leptien en op lewerlipiede in diabetiese rotte van tipe 2. J Pineal Res. 2003.35 (4): 251-6.
22. Ferreira DS, Amaral FG, Mesquita CC, Barbosa AP, Lellis-San-tos C, Turati AO, Santos LR, Sollon CS, Gomes PR, Faria JA, Ci-polla-Neto J, Bordin S, Anhe GF. Moedersmelatonien programmeer die daaglikse patroon van energiemetabolisme by volwasse nageslagte. PLoS One 2012.7 (6): e38795.
23. Shatilo WB, Bondarenko EB, Antonyuk-Scheglova IA. Metaboliese afwykings by ouer pasiënte met hipertensie en hul regstelling met melatonien. Gerontol sukses. 2012.25 (1): 84-89.
Diabetes mellitus. 2013, (2): 11-16
24. Prokopenko I, Langenberg C, Florez JC, Saxena R,
Soranzo N, Thorleifsson G, Loos RJ, Manning AK, Jackson AU, Aulchenko Y, Potter SC, Erdos MR, Sanna S, Hottenga JJ, Wheeler E, Kaakinen M, Lyssenko V, Chen WM, Ahmadi K, Beckmann JS, Bergman RN , Bochud M, Bonnycastle LL, Buchanan TA, Cao A, Cervino A, Coin L, Collins FS, Crisponi L, de Geus EJ, Dehghan A, Deloukas P, Doney AS, Elliott P,
Freimer N, Gateva V, Herder C, Hofman A, Hughes TE,
Hunt S, Illig T, Inouye M, Isomaa B, Johnson T, Kong A, Krestyaninova M, Kuusisto J, Laakso M, Lim N, Lindblad U, Lindgren CM, McCann OT, Mohlke KL, Morris AD, Naitza S, Orru M , Palmer CN, Pouta A, Randall J, Rathmann W, Sara-mies J, Scheet P, Scott LJ, Scuteri A, Sharp S, Sijbrands E,
Smit JH, Song K, Steinthorsdottir V, Stringham HM, Tuomi T, Tuomilehto J, Uitterlinden AG, Voight BF, Waterworth D, Wichmann HE, Willemsen G, Witteman JC, Yuan X, Zhao JH, Zeggini E, Schlessinger D, Sandhu M , Boomsma DI, Uda M, Spector TD, Penninx BW, Altshuler D, Vollenweider P, Jarv-elin MR, Lakatta E, Waeber G, Fox CS, Peltonen L, Groop LC, Mooser V, Cupples LA, Thorsteinsdottir U, Boehnke M , Bar-roso I, Van Duijn C, Dupuis J, Watanabe RM, Stefansson K, McCarthy MI, Wareham NJ, Meigs JB, Abecasis GR. Afwykings in MTNR1B beïnvloed vinnige glukosevlakke. Nat Genet. 2009.41 (1): 77-81.
25. Kelliny C., Ekelund U., Andersen L. B., Brage S., Loos R. J., Wareham N. J., Langenberg C. Algemene genetiese determinante van glukose-homeostase by gesonde kinders: die European Youth Heart Study. Diabetes 2009, 58 (12): 2939-45.
26. Reiling E, van 't Riet E, Groenewoud MJ, Welschen LM, van Hove EC, Nijpels G, Maassen JA, Dekker JM,' t Hart LM. Gekombineerde effekte van enkel-nukleotied polimorfismes in GCK, GCKR, G6PC2 en MTNR1B op vastende plasmaglukose en tipe 2-diabetesrisiko. Diabetologia 2009.52 (9): 1866-70.
27. Peschke E, Hofmann K, Bahr I, Streck S, Albrecht E, Wedekind D, Muhlbauer E. Die insulien-melatonien-antagonisme: studies in die LEW.1AR1-cut rat ('n dieremodel van menslike tipe 1-diabetes mellitus). Diabetologia 2011.54 (7): 1831-40.
28. Simsek N, Kaya M, Kara A, Can I, Karadeniz A, Kalkan Y. Effekte van melatonien op eiland-neogenese en beta-sel apoptose by streptosotosien-geïnduseerde diabetiese rotte: 'n immunohistochemiese studie. Domest Anim Endocrinol. 2012.43 (1): 47-57.
29. Peschke E, Frese T, Chankiewitz E, Peschke D, Preiss U,
Schneyer U, Spessert R, Muhlbauer E. Diabetiese Goto Kakizaki-rotte sowel as diabetiese pasiënte met tipe 2 toon 'n afname in die serum melatonienvlak in die dag en 'n verhoogde melato-nin-reseptorstelsel in die pankreas. J Pineal Res. 2006.40 (2): 135-43.
30. Mantele S, Otway DT, Middleton B, Bretschneider S, Wright J, Robertson MD, Skene DJ, Johnston JD. Daaglikse ritmes van plasma-melatonien, maar nie plasmaleptien of leptien-mRNA nie, verskil tussen maer, vetsugtige en tipe 2-diabetiese mans. PLoS One 2012.7 (5): e37123.
31. Jerieva I.S., Rapoport S.I., Volkova N.I. Die verband tussen die inhoud van insulien, leptien en melatonien by pasiënte met metaboliese sindroom. Clinical Medicine 2011.6: 46-9.
32. Grinenko T.N., Ballusek M.F., Kvetnaya T.V. Melatonien as 'n aanduiding van die erns van strukturele en funksionele veranderinge in die hart en bloedvate in die metaboliese sindroom. Kliniese Geneeskunde 2012.2: 30-4.
33. Robeva R, Kirilov G, Tomova A, Kumanov Ph. Melatonien-insulien interaksies by pasiënte met metaboliese sindroom. J. Pineal Res. 2008.44 (1): 52-56.
34. do Carmo Buonfiglio D, Peliciari-Garcia RA, doen Amaral FG, Peres R, Nogueira TC, Afeche SC, Cipolla-Neto J. Vroeë stadium
retinale melatonien sintese verswakking by streptozotosien-geïnduseerde diabetiese wistar rotte. Belê. Oftalmol Vis Sci. 2011.52 (10): 7416-22.
35. Hikichi T, Tateda N, Miura T. Verandering van melatonien-sekresie by pasiënte met tipe 2-diabetes en proliferatiewe diabetiese retinopatie. Clin. Ophthalmol. 2011.5: 655-60. doi: 1 http://dx.doi.org/o.2147/OPTH.S19559.
36. Kanter M, Uysal H, Karaca T, Sagmanligil HO. Depressie van glukosevlakke en gedeeltelike herstel van die beta-selbeskadiging van die pankreas deur melatonien by streptosotosien-geïnduseerde diabetiese rotte. Arch Toxicol. 2006.80 (6): 362-9.
37. de Oliveira AC, Andreotti S, Farias Tda S, Torres-Leal FL, de Proenga AR, Campana AB, de Souza AH, Sertie RA, Carpi-nelli AR, Cipolla-Neto J, Lima FB. Metaboliese afwykings en insulienweerstandigheid in vetweefsel by neonataal STZ-geïnduseerde diabetiese rotte word verbeter deur melatonienbehandeling op lang termyn. Endokrinologie 2012,153 (5): 2178-88.
38. Anwar MM, Meki AR. Oksidatiewe spanning by strepto-zotocine-geïnduseerde diabetiese rotte: effekte van knoffelolie en melatonien. Comp Biochem Physiol A Mol Integr Physiol. 2003,135 (4): 539-47.
39. Lin GJ, Huang SH, Chen YW, Hueng DY, Chien MW, Chia WT, Chang DM, Sytwu HK. Melatonien verleng die oorlewing van die eilandoorplanting by diabetiese NOD-muise. J Pineal Res. 2009.47 (3): 284-92.
40. Agil A, Rosado I, Ruiz R, Figueroa A, Zen N, Fernandez-Vazquez G. Melatonin verbeter glukose-homeostase by jong Zucker-diabetiese vetterige rotte. J Pineal Res. 2012.52 (2): 203-10.
41. Agil A, Reiter RJ, Jimenez-Aranda A, Iban-Arias R, Navarro-Alarcon M, Marchal JA, Adem A, Fernandez-Vazquez G. Melatonin verlig lae-inflammasie en oksidatiewe stres by jong Zucker-diabetiese vetterige rotte. J Pineal Res. 2012 In pers. doi: http://dx.doi.org/10.1111/jpi.12012.
42. Nduhirabandi F, du Toit EF, Lochner A. Melatonin en die metaboliese sindroom: 'n hulpmiddel vir effektiewe terapie in vetsug-geassosieerde abnormaliteite? Acta Physiol (Oxf). 2012 Junie 205 (2): 209-223. doi: http://dx.doi.org/10.1111/ j.1748-1716.2012.02410.x.
43. Kozirog M, Poliwczak AR, Duchnowicz P, Koter-Michalak M, Sikora J, Broncel M. Melatonin-behandeling verbeter bloeddruk, lipiedprofiel en parameters van oksidatiewe stres by pasiënte met metaboliese sindroom. J Pineal Res. 2011Apr 50 (3): 261-266. doi: http://dx.doi.org/10.1111/j.1600-079X.2010.00835.x.
44. Garfinkel D, Zorin M, Wainstein J, Matas Z, Laudon M, Zisa-pel N. Doeltreffendheid en veiligheid van melatonien met verlengde afgifte by slapeloosheid pasiënte met diabetes: 'n gerandomiseerde, dubbelblinde, oorgangstudie. Diabetes Metab Syndr Obes. 2011.4: 307-13.
45. Baydas G, Tuzcu M, Yasar A, Baydas B. Vroeë veranderinge in gliale-reaktiwiteit en lipiedperoksidasie in diabetiese rotte retina: effekte van melatonien. Acta Diabetol. 2004.41 (3): 123-8.
46. Salido EM, Bordone M, De Laurentiis A, Chianelli M, Keller Sarmiento MI, Dorfman D, Rosenstein RE. Terapeutiese effektiwiteit van melatonien in die vermindering van retinale skade in 'n eksperimentele model van vroeë tipe 2-diabetes by rotte. J Pineal Res. 2012. doi: http://dx.doi.org/10.1111/jpi.12008.
47. Ha H, Yu MR, Kim KH. Melatonien en taurien verminder vroeë glomerulopatie by diabetiese rotte. Gratis radikaat. Biol. Med. 1999.26 (7-8): 944-50.
48. Oktem F, Ozguner F, Yilmaz HR, Uz E, Dindar B. Melatonin verminder urienuitskeiding van N-asetiel-beta-D-glukosaminidase, albumien en renale oksidatiewe merkers by diabetiese rotte. Clin Exp Pharmacol Physiol. 2006.33 (1-2): 95-101.
49. Dayoub JC, Ortiz F, Lopez LC, Venegas C, Del Pino-Zuma-quero A, Roda O, Sanchez-Montesinos I, Acuna-Castroviejo D,
Diabetes mellitus. 2013, (2): 11-16
Gaan die naam van G. Sinergisme tussen melatonien en atorvastatien 52.
teen skade aan endoteelselle wat deur lipopolysakkaried veroorsaak word.
J Pineal Res. 2011.51 (3): 324-30.
50. Reyes-Toso CF, Linares LM, Ricci CR, Obaya-Naredo D,
Pinto JE, Rodriguez RR, Cardinali DP. Melatonien herstel 53.
endotheel-afhanklike ontspanning in aorta-ringe van die pankreatektomiseerde rotte. J Pineal Res. 2005.39 (4): 386-91.
51. Qiu XF, Li XX, Chen Y, Lin HC, Yu W, Wang R, Dai YT. Mobilisering van endotheel voorvader selle: een van die moontlike 54.
meganismes betrokke by die chroniese toediening van melatonien wat erektiele disfunksie by diabetiese rotte voorkom. Asiër J Androl. 2012.14 (3): 481-6.
Konenkov V.I., Klimontov V.V. Angiogenese en vasculogenese by diabetes mellitus: nuwe konsepte van die patogenese en behandeling van vaskulêre komplikasies. Diabetes mellitus 2012.4: 17-27.
Cavallo A, Daniels SR, Dolan LM, Khoury JC, Bean JA. Bloeddrukrespons op melatonien by tipe 1-diabetes. Bloeddrukrespons op melatonien by tipe 1-diabetes. Pediatr. Diabetes 2004.5 (1): 26-31.
Bondar I.A., Klimontov V.V., Koroleva E.A., Zheltova L.I. Die daaglikse dinamika van bloeddruk by pasiënte met tipe 1-diabetes mellitus met nefropatie. Probleme of Endocrinology 2003, 49 (5): 5-10.
Konenkov Vladimir Iosifovich Klimontov Vadim Valerievich
Michurina Svetlana Viktorovna Prudnikova Marina Alekseevna Ishchenko Irina Yuryevna
Akademikus van RAMS, MD, professor, direkteur, FSBI Navorsingsinstituut vir Kliniese en Eksperimentele Limfologie, Novosibirsk
MD, hoof Laboratorium vir Endokrinologie, FSBI Navorsingsinstituut vir Kliniese en Eksperimentele Limfologie, Novosibirsk E-pos: [email protected]
Dokter in Geneeskunde, Professor, Doktor in die Wetenskap Laboratorium vir funksionele morfologie van die limfstelsel, FSBI-navorsingsinstituut vir kliniese en eksperimentele limfologie, Novosibirsk Laboratorium vir Endokrinologie, FSBI Navorsingsinstituut vir Kliniese en Eksperimentele Limfologie, Novosibirsk
Ph.D., senior navorser laboratoriums vir die funksionele morfologie van die limfstelsel,
Navorsingsinstituut vir kliniese en eksperimentele limfologie, Novosibirsk