Die rol van proteïene in die menslike liggaam

Die groot belang van proteïene vir die liggaam is te danke aan hul funksies.
Die basiese funksies van proteïene wat aangebied word, illustreer die belangrikheid van hierdie klas stowwe om 'n normale menslike lewe te verseker.
In die 19de eeu het wetenskaplikes gesê:
- proteïenliggame is uniek, die kern van die lewe,
- 'n konstante metabolisme tussen lewende dinge en die omgewing is nodig.
Hierdie bepalings bly tot op hede onveranderd.
Die basiese samestelling van proteïene
Die groot molekulêre eenhede van 'n eenvoudige proteïen genaamd proteïen word gevorm deur chemies verbonde klein blokke - aminosure met identiese en verskillende fragmente. Sulke struktuurkomposisies word heteropolimere genoem. Slegs 20 verteenwoordigers van die klas aminosure word altyd in natuurlike proteïene aangetref. Die basiese samestelling van proteïene word gekenmerk deur die verpligte teenwoordigheid van koolstof - C, stikstof - N, waterstof - H, suurstof - O. Swawel - S word dikwels aangetref. Gevolglik kan fosfor - P, koper - Cu, yster - Fe, jodium - I, selenium - Se in hul samestelling wees.
Aminokarboksielsure van natuurlike proteïene word volgens chemiese struktuur en biologiese belang geklassifiseer. Chemiese indeling is belangrik vir chemici, biologies - vir almal.
In die menslike liggaam is daar altyd twee strome van transformasies:
- die afbreek, oksidasie, wegdoen van voedselprodukte,
- biologiese sintese van nuwe essensiële stowwe.
12 aminosure wat altyd in natuurlike proteïene voorkom, kan geskep word deur biologiese sintese van die menslike liggaam. Dit word uitruilbaar genoem.
8 aminosure word nooit by mense gesintetiseer nie. Dit is onontbeerlik, moet gereeld saam met kos gegee word.
Volgens die teenwoordigheid van essensiële aminokarsboksielsure word proteïene in twee klasse verdeel.
- Volledige proteïene bevat al die aminosure wat die menslike liggaam benodig. Die vereiste stel essensiële aminosure bevat proteïene van maaskaas, suiwelprodukte, pluimvee, vleis van beeste, see- en varswatervis, eiers.
- In gebrekkige proteïene kan een of meer belangrike sure ontbreek. Dit sluit plantproteïene in.
Om die kwaliteit van dieetproteïene te bepaal, vergelyk die mediese wêreldgemeenskap dit met 'n 'ideale' proteïen, wat die verhoudings van essensiële en essensiële essensiële aminosure streng bevestig. In die natuur bestaan daar nie 'n 'ideale' proteïen nie. So na aan hom soos dierlike proteïene. Plantproteïene is dikwels nie voldoende vir die normatiewe konsentrasie van een of meer aminosure nie. As die ontbrekende stof bygevoeg word, sal die proteïen volledig word.
Die belangrikste bronne van proteïene van plantaardige en dierlike oorsprong
In die huishoudelike wetenskaplike gemeenskap wat besig is met 'n uitgebreide studie van voedselchemie, staan 'n groep professore A.P. Nechaev, sy kollegas en studente uit. Die span het die proteïeninhoud bepaal in die belangrikste voedselprodukte wat op die Russiese mark beskikbaar is.
- Belangrik! Geïdentifiseerde syfers gee inligting oor die proteïeninhoud in 100 g van die produk, bevry van die eetbare deel.
- Die grootste hoeveelheid proteïene kom voor in soja, pampoenpitte en grondboontjies (34,9 - 26,3 g).
- Waardes van 20 tot 30 gram word gevind in ertjies, bone, pistache en sonneblomsaad.
- Amandels, cashewnoten, haselneute word gekenmerk deur getalle van 15 tot 20 gr.
- Okkerneute, pasta, die meeste graan (behalwe rys, mieliegrane) bevat 10 tot 15 gram proteïen per 100 gram produk.
- Rys, mieliegryn, brood, knoffel, droë appelkose val tussen 5 en 10 gr.
- In 100 gram kool, sampioene, aartappels, pruimedante, sommige beetvariëteite, is die proteïeninhoud van 2 tot 5 gram.
- Rosyne, radyse, wortels, soetrissies het min proteïene, hul indikators oorskry nie 2 gram nie.
As u nie 'n plantvoorwerp hier kon vind nie, is die proteïenkonsentrasie daarin te laag of is dit glad nie daar nie. By vrugtesap is daar byvoorbeeld baie min proteïene, in natuurlike plantaardige olies - glad nie.
- Die maksimum proteïenkonsentrasie is gevind in vangsbok, harde en verwerkte kaas, en konynvleis (van 21,1 tot 28,9 g).
- 'N Groot aantal produkte bevat 15 tot 10 gram proteïen. Dit is 'n voël, seevis (behalwe vir kaptein), beesvleis, garnale, inkvis, maaskaas, fetakaas, varswatervis.
- Kapel, hoender-eier, varkvleis bevat 12,7 tot 15 gram proteïen per 100 gram produk.
- Yoghurt, yskas word gekenmerk deur die getalle 5 - 7,1 gr.
- Melk, kefir, gegiste gebakte melk, suurroom, room bevat 2,8 tot 3 gram proteïen.
Inligting oor die belangrikste bronne van proteïene van plantaardige en dierlike oorsprong in produkte wat meerfase tegnologiese verwerking ondergaan (bredie, wors, ham, wors) is nie van belang nie. Dit word nie aanbeveel vir gereelde gesonde eetgewoontes nie. Die gebruik van sulke produkte op kort termyn is nie beduidend nie.
Die rol van proteïene in voeding
As gevolg van metaboliese prosesse in die liggaam, word voortdurend nuwe proteïenmolekules gevorm in plaas van die oues. Die tempo van sintese in verskillende organe is nie dieselfde nie. Hormoonproteïene, byvoorbeeld insulien, word baie vinnig, binne ure, minute, herstel (gesintetiseer). Proteïene van die lewer, derm slymvliese word binne tien dae herwin. Proteïenmolekules van die brein, spiere, bindweefsel word herstel, en die herstellende sintese (resintese) kan tot ses maande duur.
Die proses van benutting en sintese word gekenmerk deur 'n stikstofbalans.
- By 'n gevormde persoon met volle gesondheid is die stikstofbalans nul. In hierdie geval is die totale massa stikstof wat met proteïene tydens voeding voorsien word, gelyk aan die massa wat met vervalprodukte uitgeskei word.
- Jong organismes ontwikkel vinnig. Die stikstofbalans is positief. Daar is baie proteïene, minder word uitgeskei.
- By veroudering, siek mense, is die stikstofbalans negatief. Die massa stikstof vrygestel met metaboliese produkte is groter as wat met voedselinname ontvang word.
Die rol van proteïene in voeding is om 'n persoon die nodige hoeveelheid aminosuurkomponente te gee wat geskik is vir deelname aan die biochemiese prosesse van die liggaam.
Om 'n normale metabolisme te verseker, is dit belangrik om te weet hoeveel proteïen 'n persoon per dag moet verbruik.
Huishoudelike en Amerikaanse fisioloë beveel aan dat hulle 0,8 - 1 g proteïen per 1 kg mensegewig eet. Die getalle is redelik gemiddeld. Die hoeveelheid hang af van die ouderdom, aard van die werk, die lewenstyl van 'n persoon. Hulle beveel gemiddeld 60 tot 100 gram proteïen per dag in. Vir mans wat met fisieke werk besig is, kan die norm verhoog word tot 120 gram per dag. Vir diegene wat chirurgie, aansteeklike siektes ondergaan, neem die norm ook toe tot 140 gram per dag. Diabete word aanbeveel dat diëte met 'n hoë inhoud proteïenprodukte tot 140 g per dag kan bereik. Mense met metaboliese afwykings, wat geneig is tot jig, moet aansienlik minder proteïene inneem. Die norm vir hulle is 20 - 40 gram per dag.
Vir mense wat betrokke is in aktiewe sportsoorte wat spiermassa verhoog, neem die norm aansienlik toe, kan dit 1,6-1,8 gram per 1 kg gewig van die atleet bereik.
- Belangrik! Dit is raadsaam om die antwoord op die vraag duidelik te maak - hoeveel proteïene moet per dag tydens oefening verbruik word. Professionals het inligting oor energiekoste vir alle soorte oefeninge, maniere om die normale funksionering van die atleet se liggaam te handhaaf.
Vir die implementering van alle fisiologiese funksies is dit nie net die teenwoordigheid van essensiële aminosure in die proteïen belangrik nie, maar ook die doeltreffendheid van hul assimilasie. Proteïenmolekules het verskillende vlakke van organisasie, oplosbaarheid, mate van toeganklikheid tot verteringsensieme. 96% van melkproteïene, eiers word effektief afgebreek. In vleis, vis, word 93-95% proteïene veilig verteer. Die uitsondering is die proteïene van die vel en hare. Produkte wat plantaardige proteïene bevat, word met 60-80% verteer. In groente word 80% proteïene opgeneem, in aartappels - 70%, in brood - 62-86%.
Die aanbevole hoeveelheid proteïene uit dierlike bronne moet 55% van die totale hoeveelheid proteïenmassa wees.
- Proteïentekort in die liggaam lei tot belangrike metaboliese veranderinge. Sulke patologieë word dystrofie, kwashiorkor, genoem. Vir die eerste keer is daar 'n oortreding geopenbaar by die inwoners van die wilde stamme van Afrika, wat gekenmerk word deur 'n negatiewe stikstofbalans, verswakte dermfunksie, spieratrofie en 'n bedwelmde groei. Gedeeltelike proteïentekort kan voorkom met soortgelyke simptome, wat 'n geruime tyd kan wees. Die gebrek aan proteïene in die kind se liggaam is veral gevaarlik. Sulke dieetversteurings kan die liggaamlike en intellektuele minderwaardigheid van 'n groeiende persoon uitlok.
- Oormatige proteïene in die liggaam oorlaai die uitskeidingstelsel. Die las op die niere neem toe. Met bestaande patologieë in die nierweefsel, kan die proses vererger. Dit is baie sleg as 'n oormaat proteïen in die liggaam gepaard gaan met 'n gebrek aan ander waardevolle voedselkomponente. In antieke tye, in die lande van Asië, was daar 'n metode van teregstelling, waarin die gevonnis slegs vleis gevoer is. As gevolg hiervan het die oortreder gesterf aan die vorming van vrotprodukte in die ingewande na hierdie vergiftiging.
'N Redelike benadering om proteïene aan die liggaam te voorsien, waarborg die effektiewe werking van alle lewensstelsels.
Bestudeer die geskiedenis

Die proteïen is in 1728 vir die eerste keer (in die vorm van gluten) deur die Italiaanse Jacopo Bartolomeo Beccari uit koringmeel verkry. Proteïene is in die 18de eeu in 'n afsonderlike klas biologiese molekules geïsoleer as gevolg van die werk van die Franse chemikus Antoine de Fourcroix en ander wetenskaplikes wat kennis geneem het van die eienskappe van proteïene om te stol (denatureer) onder die invloed van hitte of sure. Destyds is proteïene soos albumien (“eierwit”), fibrien (proteïen uit die bloed) en gluten uit koringkorrels ondersoek.
Aan die begin van die 19de eeu was daar reeds inligting oor die elementêre samestelling van proteïene verkry; dit was bekend dat aminosure gevorm word tydens die hidrolise van proteïene. Sommige van hierdie aminosure (bv. Glisien en leucien) is al gekenmerk. Op grond van 'n ontleding van die chemiese samestelling van proteïene, vermoed die Nederlandse chemikus Gerrit Mulder dat byna alle proteïene 'n soortgelyke empiriese formule het. In 1836 het Mulder die eerste model van die chemiese struktuur van proteïene voorgestel. Op grond van die teorie van radikale het hy na verskeie verfynings tot die gevolgtrekking gekom dat die minimale strukturele eenheid van 'n proteïen die volgende samestelling het: C40H62N10O12. Hy noem hierdie eenheid 'proteïne' (Pr) (van die Grieks. Protos - die eerste, primêre) en die teorie 'proteïenteorie'. Die term "proteïen" word deur die Sweedse chemikus Jacob Berzelius voorgestel. Volgens Mulder bestaan elke proteïen uit verskillende proteïeneenhede, swael en fosfor. Hy het byvoorbeeld voorgestel dat hy die fibrienformule as 10PrSP skryf. Mulder het ook die produkte van die vernietiging van proteïene - aminosure bestudeer en vir een daarvan (leucine) met 'n klein breukdeel van die fout, bepaal hy die molekulêre gewig - 131 dalton. Met die versameling van nuwe gegewens oor proteïene het die proteïenteorie begin kritiseer, maar ten spyte hiervan is dit tot die laat 1850's steeds as algemeen erken.
Aan die einde van die 19de eeu is die meeste aminosure waaruit proteïene bestaan, ondersoek. In die laat 1880's. Russiese wetenskaplike A. Ya.Danilevsky het kennis geneem van die bestaan van peptiedgroepe (CO - NH) in die proteïenmolekule. In 1894 het die Duitse fisioloog Albrecht Kossel 'n teorie voorgehou waarvolgens aminosure die belangrikste strukturele elemente van proteïene is. Aan die begin van die 20ste eeu het die Duitse chemikus Emil Fischer eksperimenteel bewys dat proteïene bestaan uit aminosuurreste wat deur peptiedbindings verbind is. Hy het ook die eerste ontleding van die aminosuurvolgorde van die proteïen uitgevoer en die verskynsel van proteolise verduidelik.
Die sentrale rol van proteïene in organismes is egter eers in 1926 erken, toe die Amerikaanse chemikus James Sumner (later 'n Nobelprys vir chemie) toon dat die urease-ensiem 'n proteïen is.
Die moeilikheid om suiwer proteïene te isoleer het dit moeilik gemaak om te bestudeer. Daarom is die eerste studies uitgevoer met behulp van daardie polipeptiede wat maklik in groot hoeveelhede gesuiwer kon word, dit wil sê bloedproteïene, hoendereiers, verskillende gifstowwe, sowel as verterings- / metaboliese ensieme wat na die slag van vee geskei is. In die laat vyftigerjare het die maatskappy Armor Hot Dog Co. was in staat om 'n kilogram ribonuclease A, wat in baie studies 'n eksperimentele teiken geword het, skoon te maak.
Die idee dat die sekondêre struktuur van proteïene die gevolg is van die vorming van waterstofbindings tussen aminosuurreste, is in 1933 deur William Astbury voorgestel, maar Linus Pauling word beskou as die eerste wetenskaplike wat die sekondêre struktuur van proteïene suksesvol kon voorspel. Later het Walter Kauzman, met die vertroue op die werk van Kai Linnerstrom-Lang, 'n belangrike bydrae gelewer tot die begrip van die wette van die vorming van die tersiêre struktuur van proteïene en die rol van hidrofobiese interaksies in hierdie proses. In die laat 1940's en vroeë vyftigerjare het Frederick Senger 'n metode ontwikkel vir proteïne-opeenvolging, waardeur hy die aminosuurvolgorde van twee insulienkettings teen 1955 bepaal het, wat bewys het dat proteïene lineêre polimere van aminosure is, en nie vertak is nie (soos sommige suikers) ) kettings, kolloïede of siklusse. Die eerste proteïen waarvan die aminosuurvolgorde deur Sowjet-Russiese wetenskaplikes vasgestel is, was in 1972 aspartaataminotransferase.
Die eerste ruimtelike strukture van proteïene wat deur X-straaldiffraksie (X-straaldiffraksie-analise) verkry is, het in die laat 1950's en vroeë 1960's bekend geword, en strukture wat in die 1980's deur kernmagnetiese resonansie ontdek is. In 2012 bevat die Protein Data Bank ongeveer 87,000 proteïenstrukture.
In die 21ste eeu het proteïennavorsing na 'n kwalitatief nuwe vlak beweeg, waar nie net individuele gesuiwerde proteïene bestudeer word nie, maar ook die gelyktydige verandering in die aantal en post-translasionele modifikasies van 'n groot aantal proteïene van individuele selle, weefsels of hele organismes. Hierdie gebied van biochemie word proteomika genoem. Met behulp van bioinformatika-metodes is dit moontlik geword om nie net die data van röntgendiffraksie-analise te verwerk nie, maar ook om die struktuur van die proteïen te voorspel op grond van die aminosuurvolgorde. Op die oomblik benader die kriolektronmikroskopie van groot proteïenkomplekse en die voorspelling van die ruimtelike strukture van proteïendomeine met behulp van rekenaarprogramme die atoom akkuraatheid.

Proteïengrootte kan gemeet word in terme van aminosuurresidue of in dalton (molekulêre gewig), maar as gevolg van die relatiewe groot grootte van die molekule, word die proteïenmassa uitgedruk in afgeleide eenhede - kilodalton (kDa). Gisproteïene bestaan gemiddeld uit 466 aminosuurresidue en het 'n molekulêre gewig van 53 kDa. Die grootste proteïen wat tans bekend is - titien - is 'n bestanddeel van spiersarcomere, en die molekulêre gewig van die verskillende variante (isoforme) wissel tussen 3000 en 3700 kDa. Titien van die soleusspier (lat. Soleus) van 'n persoon bestaan uit 38.138 aminosure.
Amfoteriese
Proteïene het 'n eienskap van amfoterisiteit, dit wil sê, afhangende van die toestande, het dit suur sowel as basiese eienskappe. In proteïene is daar verskillende soorte chemiese groepe wat in 'n waterige oplossing kan ioniseer: karboksielsuurreste van die sykettings van suuraminosure (asparagine- en glutamiensure) en stikstofbevattende groepe van die sykettings van basiese aminosure (hoofsaaklik die ε-aminogroep van lysien en die amidien-residu CNH (NH)2) arginine, in 'n bietjie mindere mate - die residu van die imidazoolhistidien). Elke proteïen word gekenmerk deur 'n iso-elektriese punt (PI) - medium zuurheid (pH), waar die totale elektriese lading van die molekules van hierdie proteïen nul is en gevolglik beweeg hulle nie in die elektriese veld nie (byvoorbeeld deur elektroforese). Op die iso-elektriese punt is hidrasie en oplosbaarheid van die proteïen minimaal. Die pI-waarde hang af van die verhouding suur- en basiese aminosuurreste in 'n proteïen: vir proteïene wat baie suur aminosuurreste bevat, lê iso-elektriese punte in die suurstreek (sulke proteïene word suur genoem), en in proteïene wat meer basiese residue bevat, is hulle in die alkaliese streek (basiese proteïene) ). Die pI-waarde van hierdie proteïen kan ook wissel na gelang van die ioniese sterkte en die tipe bufferoplossing waarin dit geleë is, aangesien neutrale soute die ionisasiegraad van die chemiese groepe van die proteïen beïnvloed. Die pI van 'n proteïen kan byvoorbeeld bepaal word vanuit 'n titrasiekurwe of deur iso-elektriese fokus.
Oor die algemeen hang die pI van 'n proteïen af van die funksie wat dit verrig: die iso-elektriese punt van die meeste proteïene in gewerwelde weefsel wissel van 5,5 tot 7,0, maar in sommige gevalle lê die waardes in uiterste gebiede: byvoorbeeld vir pepsien, 'n proteolitiese ensiem van 'n sterk suur maag. sap pI
1, en vir salmien - die protamienproteïne van salmmelk, waarvan die kenmerk 'n hoë arginieninhoud is - pI
12. Proteïene wat bind aan nukleïensure as gevolg van elektrostatiese interaksie met fosfaatgroepe, is dikwels die belangrikste proteïene. 'N Voorbeeld van sulke proteïene is histone en protamiene.
Wat is proteïene?
Proteïene is komplekse organiese verbindings met 'n hoë molekulêre gewig, bestaande uit aminosuurreste, wat op 'n spesiale manier gekombineer word. Elke proteïen het sy eie individuele aminosuurvolgorde, die ligging in die ruimte. Dit is belangrik om te verstaan dat die proteïene wat in die liggaam binnekom nie in 'n onveranderde vorm deur hulle geabsorbeer word nie, dit word in aminosure afgebreek en met hul hulp sintetiseer die liggaam sy proteïene.
22 aminosure neem deel aan die vorming van proteïene, 13 daarvan kan in mekaar omgeskakel word, 9 - fenielalanien, triptofaan, lysien, histidien, treonien, leucien, valien, isoleucien, metionien - is onvervangbaar. Die gebrek aan onvervangbare sure in die liggaam is onaanvaarbaar, dit kan lei tot ontwrigting van die liggaam.
Dit is belangrik, nie net die feit dat die proteïen die liggaam binnekom nie, maar ook uit watter aminosure dit bestaan!

Wat is proteïen?
Proteïene (proteïene / polipeptiede) - organiese stowwe, natuurlike polimere wat twintig verwante aminosure bevat. Kombinasies bied baie soorte. Die liggaam hanteer die sintese van twaalf uitruilbare aminosure self.
Agt van die twintig essensiële aminosure wat in proteïene voorkom, kan nie alleen deur die liggaam gesintetiseer word nie, hulle word saam met voedsel verkry. Dit is valien, leucien, isoleucine, metionien, tryptofaan, lysien, treonien, fenielalanien, wat lewensbelangrik is.
Wat gebeur proteïen
Onderskei tussen dier en groente (volgens oorsprong). Twee soorte verbruik word benodig.
dier:
Eierwit word maklik en byna volledig deur die liggaam opgeneem (90-92%). Proteïene van gefermenteerde melkprodukte is effens erger (tot 90%). Proteïne vars volmelk word nog minder opgeneem (tot 80%).
Die waarde van beesvleis en vis in die beste kombinasie van essensiële aminosure.
plantegroei:
Soja, kanola en katjiesaad het 'n goeie verhouding van aminosure vir die liggaam. By gewasse is hierdie verhouding swakker.
Daar is geen produk met die ideale aminosuurverhouding nie. Behoorlike voeding behels 'n kombinasie van dierlike en plantaardige proteïene.
Die basis van voeding "volgens die reëls" is dierlike proteïene. Dit is ryk aan essensiële aminosure en bied goeie opname van plantaardige proteïene.
Proteïenfunksies in die liggaam
As dit in die weefsel selle is, verrig dit baie funksies:
- beskermende. Die werking van die immuunstelsel is die neutralisering van vreemde stowwe. Teenliggaamproduksie vind plaas.
- vervoer. Die verskaffing van verskillende stowwe, byvoorbeeld hemoglobien (suurstoftoevoer).
- regulatoriese. Handhawing van 'n hormonale agtergrond.
- motor. Alle soorte bewegings bied aktien en myosien.
- plastic. Die toestand van die bindweefsel word beheer deur die kollageeninhoud.
- katalitiese. Dit is 'n katalisator en versnel die deurgang van alle biochemiese reaksies.
- Bewaring en oordrag van geeninligting (DNA- en RNA-molekules).
- energie. Die verskaffing van energie deur die hele liggaam.
Ander gee asemhaling, is verantwoordelik vir die vertering van voedsel, reguleer metabolisme. Die fotosensitiewe rodopsienproteïen is verantwoordelik vir die visuele funksie.
Bloedvate bevat elastien, danksy dit werk dit ten volle. Die fibrinogeenproteïen sorg vir bloedstolling.
Simptome van 'n tekort aan proteïene in die liggaam
Proteïentekort is 'n redelike algemene voorkoms met wanvoeding en 'n hiperaktiewe leefstyl van 'n moderne mens. In 'n ligte vorm word dit uitgedruk in gereelde moegheid en swak prestasie. Met 'n toename in onvoldoende hoeveelhede, teken die liggaam simptome deur:
- Algemene swakheid en duiseligheid. Verminderde gemoedstemming en aktiwiteit, die voorkoms van spiervermoeidheid sonder spesiale fisieke inspanning, verswakte koördinasie van bewegings, verswakking van aandag en geheue.
- Hoofpyn en verslegtende slaap. Die gevolglike slapeloosheid en angs dui op 'n gebrek aan serotonien.
- Gereelde gemoedskommelings, gesukkel. 'N Gebrek aan ensieme en hormone veroorsaak uitputting van die senuweestelsel: prikkelbaarheid vir enige rede, onredelike aggressiwiteit, emosionele selfbeheersing.
- Bleek vel, uitslag. Met 'n gebrek aan ysterbevattende proteïen, ontwikkel bloedarmoede, waarvan die simptome droog en bleek van die vel, slymvliese is.
- Swelling van die ledemate. 'N Lae plasmaproteïeninhoud ontstel die balans tussen water en sout. Onderhuidvet versamel vloeistof in die enkels en enkels.
- Swak genesing van wonde en skuur. Selherstel word belemmer weens 'n gebrek aan 'boumateriaal'.
- Breekbaarheid en haarverlies, broosheid van naels. Die voorkoms van roos as gevolg van droë vel, afskilfering en krake van die spykerplaat is die algemeenste sein van die liggaam oor 'n tekort aan proteïene. Hare en naels groei voortdurend en reageer onmiddellik op 'n gebrek aan stowwe wat groei en 'n goeie toestand bevorder.
- Onredelike gewigsverlies. Die verdwyning van kilogramme vir geen oënskynlike rede is as gevolg van die behoefte aan die liggaam om te kompenseer vir die gebrek aan proteïen as gevolg van spiermassa.
- Mislukking van die hart en bloedvate, die voorkoms van kortasem. Die asemhalings-, spysverterings- en geslagstelsel is ook besig om agteruit te gaan. Dyspnee verskyn sonder liggaamlike inspanning, hoes sonder verkoues en virussiektes.
As u simptome van hierdie aard voorspel, moet u dadelik die behandeling en kwaliteit van voedsel verander, u lewenstyl heroorweeg, en as u dit vererger, moet u 'n dokter raadpleeg.
Hoeveel proteïen benodig word vir assimilasie
Die verbruikstempo per dag hang af van ouderdom, geslag, tipe werk. Die gegewens oor die standaarde word in die onderstaande tabel aangebied en is ontwerp vir normaal gewig.
Dit is opsioneel om proteïne-inname verskeie kere te verpletter. Elkeen bepaal 'n gerieflike vorm vir homself, die belangrikste ding is om die daaglikse inname te handhaaf.
| Arbeidsaktiwiteit + |
fisieke aktiwiteit
Hoë proteïeninhoud in voedsel
Erkende proteïenbevattende voedsel:
Van al die vleisvariëteite is beesvleis die eerste plek na pluimvee-inhoud: 18,9 g. Daarna varkvleis: 16,4 g, lam: 16,2 g.
Seekos en inkvis is die leiers: 18,0 g.
Die rykste vis vir proteïene is salm: 21,8 g, dan pienk salm: 21 g, snoekbaars: 19 g, makriel: 18 g, haring: 17,6 g en kabeljou: 17,5 g.
Onder suiwelprodukte hou kefir en suurroom die posisie stewig: 3,0 g, dan melk: 2,8 g.
Hoogkorrels - Hercules: 13,1 g, gierst: 11,5 g, semolina: 11,3 g
As u die norm ken en rekening hou met finansiële geleenthede, kan u 'n spyskaart korrek opstel en seker maak dat u dit met vette en koolhidrate aanvul.
Die verhouding proteïene in voeding
Die persentasie proteïene, vette, koolhidrate in 'n gesonde dieet moet (in gram) 1: 1: 4 wees. Die sleutel tot die balans van 'n gesonde gereg kan op 'n ander manier voorgestel word: proteïene 25-35%, vette 25-35%, koolhidrate 30-50%.
Op dieselfde tyd moet vette nuttig wees: olyfolie of lynolie, neute, vis, kaas.
Koolhidrate in 'n bord is harde pasta, vars groente, vrugte / droëvrugte, suurmelkprodukte.
Proteïene in porsies kan opsioneel gekombineer word: groente + diere.
Aminosure bevat proteïene
Die uitruilbare kan deur die liggaam self gesintetiseer word, maar hul toevoer van buite is nooit oorbodig nie. Veral met 'n aktiewe lewenstyl en 'n groot fisieke inspanning.
Almal sonder uitsondering is belangrik, waarvan die gewildste is:
Alanien.
Dit stimuleer die metabolisme van koolhidrate, help om gifstowwe uit te skakel. Verantwoordelik vir “netheid”. Hoë inhoud in vleis, vis, suiwelprodukte.
arginine.
Dit is nodig om spiere, gesonde vel, kraakbeen en gewrigte saam te trek. Voorsien vetverbranding en immuunstelselfunksie. Dit is in vleis, melk, neute, gelatien.
Asparaginsuur.
Bied energiebalans. Verbeter die funksionaliteit van die sentrale senuweestelsel. Vul die energiebron van bees- en hoendergeregte, melk, rietsuiker aan. Bevat in aartappels, neute, graan.
Histidien.
Die belangrikste "bouer" van die liggaam word omgeskakel in histamien en hemoglobien. Genees wonde vinnig, is verantwoordelik vir groeimeganismes. Relatief baie melk, graan en vleis.
Serien.
Neurotransmitter, onmisbaar vir die duidelike werking van die brein en sentrale senuweestelsel. Daar is grondboontjies, vleis, graan, soja.
Met die regte voeding en die regte manier van lewe, sal alle aminosure in die liggaam verskyn vir die sintese van "kubusse" en modellering van gesondheid, skoonheid en lang lewe.
Wat veroorsaak 'n tekort aan proteïene in die liggaam
- Gereelde aansteeklike siektes, verswakking van die immuunstelsel.
- Spanning en angs.
- Veroudering en verlangsaming van alle metaboliese prosesse.
- 'N Newe-effek van die gebruik van individuele medikasie.
- Mislukkings in die spysverteringskanaal.
- Besering.
- Kos gebaseer op kitskos, kitsprodukte, halfafgewerkte produkte van lae gehalte.
Die tekort aan 'n enkele aminosuur sal die produksie van 'n spesifieke proteïen stop. Die liggaam is georganiseer volgens die beginsel van "vul die leemtes", dus sal die ontbrekende aminosure uit ander proteïene onttrek word. Hierdie "heropbou" ontwrig die werking van organe, spiere, hart, brein en veroorsaak gevolglik die siekte.
Proteïentekort by kinders belemmer groei, veroorsaak fisieke en geestelike gestremdhede.
Die ontwikkeling van bloedarmoede, die voorkoms van velsiektes, patologie van been- en spierweefsel is nie 'n volledige lys van siektes nie. Ernstige proteïnedistrofie kan lei tot waansin en kwashiorkor (tipe ernstige distrofie weens 'n gebrek aan proteïene).
Wanneer proteïne die liggaam benadeel
- oortollige ontvangs
- chroniese siektes van die lewer, niere, hart en bloedvate.
Ooraanbod vind nie gereeld plaas nie as gevolg van onvolledige opname van 'n stof deur die liggaam.Dit kom voor by diegene wat die spier so vinnig moontlik wil verhoog sonder om die aanbevelings van opleiers en voedingkundiges te volg.
Die probleme van 'oortollige' onthaal sluit in:
Nierversaking. Oormatige hoeveelhede organe wat oorlaai word, beïnvloed hul natuurlike funksie. "Filter" kan nie die las hanteer nie, niersiekte verskyn.
Lewersiekte. Oormatige proteïen versamel ammoniak in die bloed, wat die toestand van die lewer vererger.
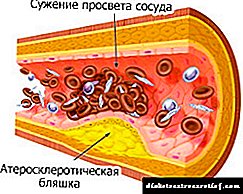
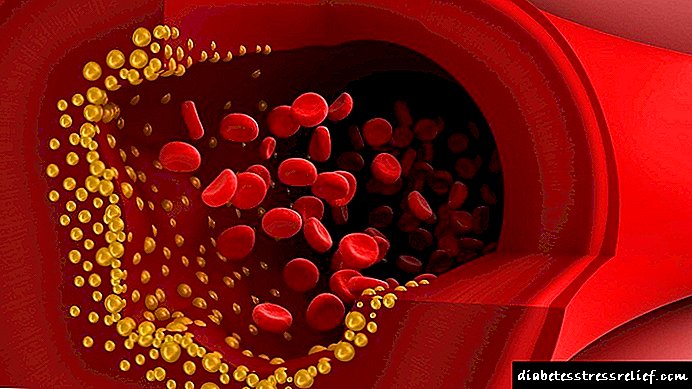
Die ontwikkeling van aterosklerose. Die meeste diereprodukte bevat benewens bruikbare stowwe skadelike vet en cholesterol.
Mense wat aan patologie van die lewer, niere, kardiovaskulêre en spysverteringstelsels ly, moet die inname van proteïene beperk.
Omgee vir hul eie gesondheid word baie goed beloon vir diegene wat daaroor bekommerd is. Om ernstige gevolge te voorkom, moet u die liggaam se behoefte aan herstel onthou. 'N Vol rus, voeding en besoekende spesialiste sal jeug, gesondheid en lewe verleng.
Oplosbaarheid
Proteïene wissel in oplosbaarheid in water. Wateroplosbare proteïene word albumien genoem, dit sluit bloed- en melkproteïene in. Om onoplosbare, of skleroproteïene in te sluit, sluit byvoorbeeld keratien in (die proteïen wat die hare uitmaak, soogdiere, vere van voëls, ens.) En fibroien, wat deel is van sy en spinnerakke. Die oplosbaarheid van 'n proteïen word nie net deur die struktuur daarvan bepaal nie, maar deur eksterne faktore, soos die aard van die oplosmiddel, ioniese sterkte en die pH van die oplossing.
Proteïene word ook in hidrofil (wateroplosbaar) en hidrofobies (waterafstotend) verdeel. Die meeste proteïene van die sitoplasma, kern en intersellulêre stof, insluitend onoplosbare keratien en fibroïen, is hidrofilies. Die meeste proteïene wat biologiese membrane vorm, is hidrofobies - integrale membraanproteïene wat in wisselwerking is met hidrofobiese lipiede van die membraan (hierdie proteïene het gewoonlik ook hidrofiliese terreine).
Proteïenbiosintese in die liggaam
Proteïne-biosintese - die vorming in die liggaam van die gewenste proteïene uit aminosure deur dit te kombineer met 'n spesiale soort chemiese binding - die polipeptiedketting. DNA berg inligting oor proteïenstruktuur. Die sintese self vind plaas in 'n spesiale deel van die sel wat die ribosoom genoem word. RNA dra inligting vanaf die gewenste geen (DNA-plek) na die ribosoom oor.
Aangesien proteïenbiosintese veelvlakkig, kompleks is, gebruik die inligting wat neergelê is in die basis van menslike bestaan - DNA, is die chemiese sintese daarvan 'n moeilike taak. Wetenskaplikes het geleer hoe om inhibisies van sekere ensieme en hormone te bekom, maar die belangrikste wetenskaplike taak is om proteïene te verkry deur genetiese manipulasie te gebruik.

Vervoer
Die vervoerfunksie van 'n spesiale bloedproteïen - hemoglobien. Danksy hierdie proteïen word suurstof vanaf die longe na die organe en weefsel van die liggaam afgegee.
Dit bestaan uit die aktiwiteit van proteïene van die immuunstelsel wat teenliggaampies genoem word. Dit is teenliggaampies wat die gesondheid van die liggaam beskerm en dit beskerm teen bakterieë, virusse, gifstowwe en toelaat dat bloed 'n stolsel vorm in die plek van 'n oop wond.
Die seinfunksie van proteïene is om seine (inligting) tussen selle oor te dra.
Proteïennorme vir 'n volwassene
Die behoefte van die menslike liggaam aan proteïene hang direk van die fisieke aktiwiteit af. Hoe meer ons beweeg, hoe vinniger gaan alle biochemiese reaksies in ons liggaam voort. Mense wat gereeld oefen, benodig byna twee keer soveel proteïne as die gemiddelde persoon. 'N Gebrek aan proteïene vir mense wat aan sport deelneem, is gevaarlik om die spiere te "uitdroog" en die uitputting van die hele liggaam!
Gemiddeld word die proteïennorm vir 'n volwassene bereken op grond van 'n koëffisiënt van 1 g proteïen per 1 kg gewig, dit wil sê ongeveer 80-100 g vir mans, 55-60 g vir vroue. Manlike atlete word aangeraai om die hoeveelheid proteïen wat verbruik word, tot 170-200 g per dag te verhoog.

Behoorlike proteïenvoeding vir die liggaam
Behoorlike voeding om die liggaam met proteïne te versadig, is 'n kombinasie van dierlike en plantproteïene. Die mate van assimilasie van proteïene uit voedsel hang af van die oorsprong daarvan en die metode van hittebehandeling.
Dus word ongeveer 80% van die totale inname van dierlike proteïene en 60% plantaardige proteïen deur die liggaam opgeneem. Produkte van dierlike oorsprong bevat 'n groter hoeveelheid proteïen per massa-eenheid van die produk as in groente. Daarbenewens bevat die samestelling van "dierlike" produkte alle aminosure, en plantprodukte in hierdie verband word as minderwaardig beskou.
Basiese voedingsreëls vir beter opname van proteïene:
- 'N Sagmoedige manier van kook - kook, stoom, steek. Braai moet uitgesluit word.
- Dit word aanbeveel om meer vis en pluimvee te eet. As u regtig vleis wil hê, kies dan beesvleis.
- Boude moet uitgesluit word van die dieet; dit is vetterig en skadelik. In uiterste gevalle kan u die eerste gereg kook met behulp van die "sekondêre sous".
Kenmerke van proteïenvoeding vir spiergroei
Atlete wat aktief spiermassa kry, moet al die bogenoemde aanbevelings nakom. Die meeste van hul dieet moet proteïene van dierlike oorsprong wees. Hulle moet geëet word saam met plantaardige proteïenprodukte, waarvan soja die voorkeur geniet.
Dit is ook nodig om 'n dokter te raadpleeg en die gebruik van spesiale proteïendrankies te oorweeg, waarvan die persentasie proteïenabsorpsie 97-98% is. Die spesialis kies 'n drankie afsonderlik en bereken die korrekte dosis. Dit sal 'n aangename en nuttige proteïenaanvulling tot kragopleiding wees.
Denaturasie
Proteïen denaturasie verwys na enige veranderinge in die biologiese aktiwiteit en / of fisiese-chemiese eienskappe wat verband hou met die verlies van 'n kwaternêre, tersiêre of sekondêre struktuur (sien die afdeling "Proteïenstruktuur"). In die reël is proteïene redelik stabiel onder daardie toestande (temperatuur, pH, ens.) Waarin hulle normaalweg in die liggaam funksioneer. 'N Skerp verandering in hierdie toestande lei tot proteïen denaturasie. Afhangend van die aard van die denatureringsmiddel word meganiese (sterk roer of skud), fisiese (verhitting, verkoeling, bestraling, sonication) en chemiese (sure en alkalies, benatter, ureum) denaturering onderskei.
Proteïen denaturasie kan volledig of gedeeltelik, omkeerbaar of onomkeerbaar wees. Die bekendste geval van onomkeerbare proteïen denaturasie in die alledaagse lewe, is die bereiding van 'n hoendereier, wanneer die wateroplosbare, deursigtige proteïne ovalbumine onder die invloed van 'n hoë temperatuur dig, onoplosbaar en ondeursigtig word. Denaturering is in sommige gevalle omkeerbaar, soos in die geval van neerslag van wateroplosbare proteïene met ammoniumsoute (soutmetode), en hierdie metode word gebruik om dit skoon te maak.
Proteïnemolekules is lineêre polimere wat bestaan uit residue van α-L-aminosure (wat monomere is), en ook gemodifiseerde aminosuurresidue en komponente van nie-aminosuur aard kan by die samestelling van proteïene ingesluit word. In die wetenskaplike literatuur word afkorting van een of drie letters gebruik om na aminosure te verwys. Alhoewel dit met die eerste oogopslag mag lyk of die gebruik van “slegs” 20 soorte aminosure in die meeste proteïene die verskeidenheid proteïenstrukture beperk, is die aantal opsies in werklikheid moeilik oorskat: vir 'n ketting van 5 aminosuurreste is dit al meer as 3 miljoen en 'n ketting van 100 aminosuurreste (klein proteïene) kan in meer as 10.130 variante voorgestel word. Proteïene van 2 tot 'n paar tientalle aminosuurreste word dikwels genoem peptiede, met 'n groter mate van polimerisasie - proteïene, hoewel hierdie verdeling baie arbitrêr is.
Wanneer proteïen gevorm word as gevolg van die interaksie van die α-karboksielgroep (-COOH) van een aminosuur met die α-aminogroep (-NH2) van 'n ander aminosuur word peptiedbindings gevorm. Die ente van die proteïen word die N- en C-terminus genoem, afhangende van watter groepe van die terminale aminosuurresidu vry is: -NH2 of -COOH, onderskeidelik. In proteïensintese op die ribosoom is die eerste (N-terminale) aminosuurresidue die metionienreste, en daaropvolgende residue word aan die C-terminus van die vorige geheg.
Kenmerke van proteïenvoeding, dieeters
Diegene wat gewig wil verloor, moet dierlike en plantaardige proteïenprodukte eet. Dit is belangrik om hul inname te skei, want die tyd vir hul assimilasie is anders. Vet vleisprodukte moet weggegooi word, aartappels moet nie misbruik word nie, graan met 'n gemiddelde proteïeninhoud moet verkies word.
Moenie tot uiterstes gaan en "gaan sit" op 'n proteïendieet nie. Dit pas nie by almal nie, want die volledige uitsluiting van koolhidrate sal lei tot 'n afname in werkvermoë en energie. Dit is genoeg om soggens kos te bevat wat koolhidrate bevat - dit gee energie gedurende die dag, in die namiddag, proteïenvoedsel met 'n lae proteïen. Om op te maak met die gebrek aan energie in die aand, sal die liggaam liggaamsvet begin verbrand, maar hierdie proses is veilig vir die gesondheid van die liggaam.
Neem die regte en behoorlik voorbereide proteïenvoedsel in u dieet in. Vir die liggaam is proteïene die belangrikste boumateriaal! Saam met gereelde oefening sal dit u help om 'n pragtige atletiekliggaam op te bou!
Proteïene is die belangrikste chemiese verbindings, waarsonder die lewensbelangrike werking van die liggaam onmoontlik sou wees. Proteïene bestaan uit ensieme, selle van organe, weefsels. Hulle is verantwoordelik vir metaboliese, vervoer en baie ander prosesse wat in die menslike liggaam plaasvind. Proteïene kan nie "in reservaat" ophoop nie, daarom moet hulle gereeld ingeneem word. Dit is veral belangrik vir mense wat aan sport deelneem, omdat proteïene gereguleer word.
Organisasievlakke

K. Lindstrom-Lang het voorgestel om 4 vlakke van die strukturele organisasie van proteïene te onderskei: primêre, sekondêre, tersiêre en kwaternêre strukture. Alhoewel hierdie verdeling ietwat verouderd is, word dit steeds gebruik. Die primêre struktuur (volgorde van aminosuurreste) van 'n polipeptied word bepaal deur die struktuur van sy geen en genetiese kode, en strukture van hoër orde word gevorm tydens proteïenvou. Alhoewel die ruimtelike struktuur van die proteïen in sy geheel bepaal word deur die aminosuursekwensie, is dit redelik labiel en kan dit van eksterne toestande afhang, is dit dus korrek om te praat oor die voorkeur of die mees energiek gunstige proteïenkonformasie.
Primêre struktuur

Die primêre struktuur is die volgorde van aminosuurreste in die polipeptiedketting. Die primêre struktuur van 'n proteïen word tipies beskryf met behulp van enkel- of drieletterbenamings vir aminosuurreste.
Belangrike kenmerke van die primêre struktuur is konserwatiewe motiewe - stabiele kombinasies van aminosuurreste wat 'n sekere funksie verrig en in baie proteïene voorkom. Konserwatiewe motiewe word bewaar tydens die evolusie van spesies; dit is dikwels moontlik om die funksie van 'n onbekende proteïen daaruit te voorspel. Die mate van homologie (ooreenkoms) van die aminosuurvolgorde van proteïene van verskillende organismes kan gebruik word om die evolusionêre afstand tussen die taksa waaraan hierdie organismes behoort te skat.
Die primêre struktuur van 'n proteïen kan bepaal word deur proteïne-opeenvolgingmetodes of deur die primêre struktuur van die mRNA deur gebruik te maak van die genetiese kodetabel.
Sekondêre struktuur
Die sekondêre struktuur is die plaaslike ordening van 'n fragment van 'n polypeptiedketting wat deur waterstofbindings gestabiliseer is.Die volgende is die algemeenste soorte sekondêre proteïenstruktuur:
- α-helikse is digte draaie om die lang as van die molekule. Een beurt is 3,6 aminosuurreste, die helikshoogte is 0,54 nm (0,15 nm val op een aminosuurresidu). Die spiraal word gestabiliseer deur waterstofbindings tussen die H- en O-peptiedgroepe, met 4 eenhede van mekaar. Alhoewel die α-heliks links- of regshandig kan wees, oorheers die regshandiges in proteïene. Die spiraal word onderbreek deur die elektrostatiese interaksies van glutamiensuur, lisien, arginien. Asparagien-, serien-, treonien- en leucienreste naby mekaar kan die vorming van die heliks sterries beïnvloed; prolienreste veroorsaak kettingbuiging en ontwrig ook α-helikse,
- β-velle (gevoude lae) is verskillende sigsag-polipeptiedkettings waarin waterstofbindings gevorm word tussen relatief verafgeleë aminosure (0,34 nm per aminosuurresidu) in die primêre struktuur of verskillende proteïenkettings (eerder as in 'n noue afstand, soos die geval is) wees in die α-heliks). Hierdie kettings word gewoonlik in die teenoorgestelde rigtings deur die N-ente gerig (antiparallelle oriëntasie) of in een rigting (parallel ß-struktuur). Dit is ook moontlik dat daar 'n gemengde ß-struktuur bestaan wat uit parallelle en antiparallele ß-strukture bestaan. Vir die vorming van ß-velle is klein groottes van die newe-groepe van aminosure belangrik, meestal oorheers glisien en alanien,
- π-heliks,
- 310heliks,
- ongeordende fragmente.
Tersiêre struktuur

Die tersiêre struktuur is die ruimtelike struktuur van die polipeptiedketting. Struktureel bestaan dit uit elemente van 'n sekondêre struktuur wat gestabiliseer word deur verskillende tipes interaksies waarin hidrofobiese interaksies 'n belangrike rol speel. Die stabilisering van die tersiêre struktuur behels:
- kovalente bindings (tussen die twee cysteïenreste - disulfied-brûe),
- ioniese bindings tussen teenoorgesteld gelaaide sygroepe aminosuurreste,
- waterstofbindings
- hidrofobiese interaksies. As daar met die omringende watermolekules in wisselwerking is, word die proteïenmolekule so gevou dat die nie-polêre sygroepe aminosure van die waterige oplossing geïsoleer word, en polêre hidrofiliese sygroepe verskyn op die oppervlak van die molekule.
Studies van die beginsels van proteïenvouing het getoon dat dit gerieflik is om 'n ander vlak te onderskei tussen die vlak van die sekondêre struktuur en die atoom ruimtelike struktuur - die voumotief (argitektuur, struktuurmotief). Die stileringmotief word bepaal deur die onderlinge rangskikking van die sekondêre struktuurelemente (α-helices en β-stringe) binne die proteïendomein - 'n kompakte bol wat op sigself kan bestaan óf kan deel uitmaak van 'n groter proteïen saam met ander domeine. Beskou byvoorbeeld een van die kenmerkende motiewe van die struktuur van proteïene. Die bolvormige proteïen getoon in die figuur regs, triosophosphatisomerase, het 'n voumotief wat 'n α / ß-silinder genoem word: 8 parallelle β-stringe vorm 'n ß-silinder in 'n ander silinder wat bestaan uit 8 α-helikse. Hierdie motief word in ongeveer 10% proteïene aangetref.
Dit is bekend dat stylmotiewe redelik konserwatief is en gevind word in proteïene wat nie funksionele of evolusionêre verwantskappe het nie. Bepaling van stylmotiewe is die grondslag vir die fisiese of rasionele klassifikasie van proteïene (soos CATH of SCOP).
Om die ruimtelike struktuur van die proteïen te bepaal, word metodes gebruik vir x-straaldiffraksie-analise, kernmagnetiese resonansie en sommige soorte mikroskopie.
Kwaternêre struktuur
Die kwaternêre struktuur (of subeenheid, domein) is die onderlinge rangskikking van verskillende polipeptiedkettings in 'n enkele proteïenkompleks.Die proteïenmolekules wat die proteïen met die kwaternêre struktuur uitmaak, word afsonderlik op die ribosome gevorm en slegs na die einde van die sintese vorm hulle 'n algemene supramolekulêre struktuur. 'N Kwaternêre proteïen kan identiese en verskillende polipeptiedkettings bevat. Die stabilisering van die kwaternêre struktuur behels dieselfde tipes interaksies as by die stabilisering van die tersiêre. Supramolekulêre proteïenkomplekse kan bestaan uit tientalle molekules.
Indeling volgens tipe gebou
Proteïene kan in drie groepe verdeel word volgens die algemene struktuurtipe:
- Fibrillêre proteïene - vorm polimere; hul struktuur is gewoonlik baie gereeld en word hoofsaaklik ondersteun deur interaksies tussen verskillende kettings. Dit vorm mikrofilamente, mikrotubules, fibrille en ondersteun die struktuur van selle en weefsels. Fibrillêre proteïene sluit keratien en kollageen in.
- Globale proteïene is wateroplosbaar, die algemene vorm van die molekule is min of meer sferies.
- Membraanproteïene - het gebiede wat die selmembraan kruis, maar dele van hulle steek uit die membraan in die intersellulêre omgewing en die sitoplasma van die sel uit. Membraanproteïene dien as reseptore, dit wil sê dat hulle seine oordra, en bied ook transmembraantransport van verskillende stowwe. Proteïentransporteurs is spesifiek, elkeen stuur slegs sekere molekules of 'n sekere soort sein deur die membraan.
Eenvoudige en komplekse proteïene
Benewens peptiedkettings, bevat baie proteïene ook nie-aminosuurgroepe, en volgens hierdie maatstaf word proteïene in twee groot groepe verdeel - eenvoudige en komplekse proteïene (proteïene). Eenvoudige proteïene bestaan slegs uit polipeptiedkettings, komplekse proteïene bevat ook nie-aminosuur- of prostetiese groepe. Afhangend van die chemiese aard van die prostetiese groepe, word die volgende klasse tussen komplekse proteïene onderskei:
- Glikoproteïne wat kovalent gekoppelde koolhidraatreste bevat as 'n prostetiese groep, glykoproteïene wat mukopolisakkariedreste bevat, behoort tot die subklas van proteoglycans. Hidroksielgroepe serien of treonien is gewoonlik betrokke by die vorming van 'n binding met koolhidraatreste. Die meeste ekstrasellulêre proteïene, veral immunoglobuliene, is glikoproteïene. In proteoglycans is die koolhidraat deel
95% van die totale massa van die proteïenmolekule, dit is die belangrikste komponent van die intersellulêre matriks,
2. Die biologiese belang van die voortplanting van organismes. Voortplantingsmetodes.
1. Reproduksie en die betekenis daarvan.
Voortplanting - voortplanting van soortgelyke organismes, wat voorsien
die bestaan van spesies vir baie millennia dra by tot 'n toename in
die aantal individue van die spesie, die kontinuïteit van die lewe. Seksuele, seksuele en
vegetatiewe voortplanting van organismes.
2. Aseksuele voortplanting is die oudste manier. die
een organisme is betrokke by seksloosheid, terwyl die meeste gereeld aan seksueel deelneem
twee individue. By plante, aseksuele voortplanting met spore - een
gespesialiseerde selle. Voortplanting deur spore van alge, mos, perdestert,
plunderaars, varings. Uitslag van spore van plante, ontkieming en ontwikkeling van
hulle nuwe filiaalorganismes in gunstige omstandighede. Die dood van 'n groot getal
geskil wat in ongunstige omstandighede val. Lae waarskynlikheid van voorkoms
nuwe organismes uit spore omdat dit min voedingstowwe bevat
die saailing neem dit hoofsaaklik uit die omgewing op.
3. Vegetatiewe voortplanting - voortplanting van plante met
met behulp van vegetatiewe organe: lug- of ondergrondse lote, dele van die wortel,
blaar, knol, bolle. Deelname aan die vegetatiewe voortplanting van een organisme
of dele daarvan. Die affiniteit van die dogterplant met die moeder
gaan voort met die ontwikkeling van die moeder se liggaam. Groot doeltreffendheid en
die verspreiding van vegetatiewe voortplanting in die natuur as 'n hulporganisme
vinniger gevorm uit die moederlike deel as uit die spore. Vegetatiewe voorbeelde
teling: wortelstokke gebruik - lelie van die vallei, kruisement, koringgras, ens., wortels
onderste takke wat aan die grond raak (lê) - aalbessies, wilde druiwe, snor
- aarbeie, bolle - tulp, narcis, krokus. Gebruik van vegetatief
broei wanneer gekweekte plante gekweek word: aartappels word deur knolle voortgeplant,
bolle - uie en knoffel, gelaagd - aalbessies en kruisbessies, wortel
nageslag - kersie, pruim, steggies - vrugtebome.
4. Seksuele voortplanting. Die kern van seksuele voortplanting
in die vorming van kiemselle (gamete), die samesmelting van die manlike kiemsel
(sperm) en vroulik (eier) - bevrugting en die ontwikkeling van 'n nuwe
'n dogterorganisme van 'n bevrugte eier. Danksy bemesting
'n hulporganisme met 'n meer diverse stel chromosome, wat met meer beteken
verskillende oorerflike eienskappe, waardeur dit kan blyk te wees
meer aangepas by die habitat. Die teenwoordigheid van seksuele voortplanting in
alge, mosse, varings, gimnosperme en angiosperme. komplikasie
die seksuele proses by plante tydens hul evolusie, die voorkoms van die mees komplekse
vorm in saadplante.
5. Voortplanting van saad vind plaas met behulp van sade,
dit is kenmerkend van gimnosperme en angiosperme (angiosperme)
vegetatiewe voortplanting is ook wydverspreid). Volgorde van stappe
saadvermeerdering: bestuiwing - oordrag van stuifmeel na die stigma van 'n pistil, sy
ontkieming, opkoms deur twee sperms te verdeel, en hul vordering in
ovule, dan die samesmelting van een sperm met 'n eier, en die ander met
sekondêre kern (in angiosperme). Vorming van saadknop -
die embrio met voedingstowwe, en vanaf die wande van die eierstok - die fetus. Saad -
die kiem van 'n nuwe plant, in gunstige omstandighede, spruit dit die eerste keer uit
saailinge word gevoer deur die voedingstowwe van die saad, en dan met die wortels daarvan
begin om water en minerale uit die grond op te neem, en die blare - koolstofdioksied
gas uit die lug in die sonlig. Die onafhanklike lewe van 'n nuwe aanleg.
Proteïne biofisika
Fisiese eienskappe van die proteïen in die sel, met inagneming van die watermembraan en die druk van makromolekules (eng.) baie ingewikkeld. Die hipotese van 'n proteïen as 'n geordende "kristalagtige stelsel" - 'n "aperiodiese kristal" - word ondersteun deur röntgendiffraksie-analise (tot 'n resolusie van 1 angstrom), hoë pakdigtheid, samewerking van die denatureringsproses en ander feite.
Ten gunste van 'n ander hipotese, word die vloeistofagtige eienskappe van proteïene in die prosesse van intraglobulêre bewegings (model van beperkte hopping of deurlopende diffusie) bewys deur eksperimente op neutronverspreiding, Mössbauer-spektroskopie.

Universele metode: ribosomale sintese
Proteïene word gesintetiseer deur lewende organismes uit aminosure gebaseer op inligting wat in gene gekodeer is. Elke proteïen bestaan uit 'n unieke reeks aminosuurreste wat bepaal word deur die nukleotiedvolgorde van die geen wat die proteïen kodeer. Die genetiese kode is 'n metode om die nukleotiedvolgorde van DNA (via RNA) in die aminosuurvolgorde van 'n polipeptiedketting te vertaal. Hierdie kode bepaal die korrespondensie van trinukleotiedgedeeltes van RNA, genaamd kodons, en sekere aminosure wat in die proteïen opgeneem is: die AUG-nukleotiedvolgorde stem byvoorbeeld ooreen met metionien. Aangesien DNA uit vier soorte nukleotiede bestaan, is die totale aantal moontlike kodons 64, en aangesien 20 aminosure in proteïene gebruik word, word baie aminosure deur meer as een kodon bepaal. Drie kodons is onbeduidend: dit dien as stopseine vir die sintese van die polypeptiedketting en word termineringskodone genoem, of stopkodone.
Gene wat proteïene kodeer, word eers getranskribeer in die nukleotiedvolgorde van boodskapper-RNA (mRNA) deur RNA-polimerase-ensieme. In die oorgrote meerderheid van die gevalle word die proteïene van lewende organismes op ribosome gesintetiseer - multikomponent molekulêre masjiene teenwoordig in die sitoplasma van selle. Die proses om 'n polipeptiedketting deur 'n ribosoom op 'n mRNA-matriks te sintetiseer, word vertaling genoem.
Ribosomale proteïensintese is fundamenteel dieselfde in prokariote en eukariote, maar verskil in sommige besonderhede. Prokaryotiese mRNA kan dus deur ribosome in die aminosuurvolgorde van proteïene gelees word onmiddellik na transkripsie of selfs voordat dit voltooi is. In eukariote moet die primêre transkripsie eers deur 'n reeks modifikasies gaan en in die sitoplasma (na die plek van die ribosoom) beweeg voordat die vertaling kan begin. Die tempo van proteïensintese is hoër in prokariote en kan 20 aminosure per sekonde bereik.

Aminosuur-tRNA-sintetase-ensieme heg selfs amper voor die begin van die vertaling aminosure aan hul ooreenstemmende transport-RNA (tRNA). 'N Streek van tRNA, 'n antikodon genoem, kan aanvullend met 'n mRNA-kodon saambind, en sodoende word 'n aminosuurresidu wat aan tRNA gekoppel is, in die polipeptiedketting ingesluit volgens die genetiese kode.
Gedurende die eerste fase van translasie, inisiëring, word die inisieerder (gewoonlik metionien) kodon erken deur die klein subeenheid van die ribosoom waaraan die aminosacileerde metionien-tRNA gekoppel is met behulp van proteïen-faktore. Nadat die beginkodon herken is, sluit 'n groot subeenheid by die klein subeenheid van die ribosoom aan, en die tweede fase van die vertaling, die verlenging, begin. By elke stap van die ribosoom van die 5'- tot 3'-einde van die mRNA word een kodon gelees deur waterstofbindings tussen die vorming van die RNA en die RNA-aanvulling daaraan te vorm, waaraan die ooreenstemmende aminosuurresidus geheg is. Die vorming van 'n peptiedbinding tussen die laaste aminosuurresidu van die groeiende peptied en die aminosuurresidu wat aan tRNA geheg is, word gekataliseer deur ribosomale RNA (rRNA), wat die peptidyltransferase sentrum van die ribosoom vorm. Hierdie sentrum plaas die stikstof- en koolstofatome in 'n gunstige posisie vir die reaksie. Die derde en laaste fase van translasie, terminering vind plaas wanneer die ribosoom die stopkodon bereik, waarna proteïenbeëindigingsfaktore die verband tussen die laaste tRNA en die polypeptiedketting hydroliseer, en sodoende die sintese daarvan stop. In ribosome word proteïene altyd van die N- tot die C-terminus gesintetiseer.
Neribosomale sintese
By laer swamme en sommige bakterieë is 'n addisionele (nie-ribosomale of multienzyme) metode vir biosintese van peptiede, gewoonlik met 'n klein en ongewone struktuur, bekend.Die sintese van hierdie peptiede, gewoonlik sekondêre metaboliete, word uitgevoer deur 'n proteïenkompleks met 'n hoë molekulêre gewig, NRS-sintase, sonder die direkte deelname van ribosome. NRS-sintase bestaan gewoonlik uit verskeie domeine of individuele proteïene wat aminosure selekteer, 'n peptiedbinding vorm en 'n gesintetiseerde peptied vrystel. Gesamentlik vorm hierdie domeine die module. Elke module verseker die insluiting van een aminosuur in die gesintetiseerde peptied. NRS-sintases kan dus uit een of meer modules bestaan. Soms bevat hierdie komplekse 'n domein wat L-aminosure (normale vorm) in 'n D-vorm kan isomeriseer.
Chemiese sintese
Kort proteïene kan chemies gesintetiseer word met behulp van organiese sintese-metodes, byvoorbeeld chemiese ligering. Dikwels vind chemiese sintese van die peptied plaas in die rigting van die C-terminus na die N-terminus, in teenstelling met die ribosoombiosintese. Die metode van chemiese sintese produseer kort immunogene peptiede (epitope), wat dan in diere ingespuit word om spesifieke teenliggaampies of hibridome te verkry. Daarbenewens word hierdie metode ook gebruik om remmers van sekere ensieme te verkry. Chemiese sintese maak dit moontlik om aminosuurreste in te voer wat nie in konvensionele proteïene aangetref word nie, byvoorbeeld dié met fluoressensie-etikette wat aan hul sykettings geheg is. Chemiese metodes vir die sintese van proteïene het verskillende beperkings: dit is ondoeltreffend met 'n proteïenlengte van meer as 300 aminosuurreste, kunsmatig gesintetiseerde proteïene kan 'n onreëlmatige tersiêre struktuur hê en het nie 'n kenmerkende post-translasionele modifikasie nie (sien hieronder).
Na-translasie wysiging

Nadat die vertaling voltooi is, ondergaan die meeste proteïene verdere chemiese modifikasies genaamd post-translasionele modifikasies. Meer as tweehonderd variante van post-translasionele modifikasies van proteïene is bekend.
Na-translasionele modifikasies kan die lewensduur van proteïene in die sel, hul ensiematiese aktiwiteit en interaksies met ander proteïene gereguleer word. In sommige gevalle is post-translasionele modifikasies 'n verpligte stadium van proteïenveroudering, anders is dit funksioneel onaktief. Byvoorbeeld, met die rypwording van insulien en sommige ander hormone, is 'n beperkte proteolise van die polipeptiedketting nodig, en met die rypwording van plasmamembraanproteïene is glikosilering nodig.
Na-translasie wysigings kan wydverspreid en skaars voorkom, tot uniek. 'N Voorbeeld van 'n universele modifikasie is ubiquitinasie (verbinding van 'n ketting van verskillende molekules van die kort ubiquitienproteïne aan 'n proteïen), wat dien as 'n sein vir die splitsing van hierdie proteïen deur die proteasoom. 'N Ander algemene modifikasie is glikosilering - daar word beraam dat ongeveer die helfte van menslike proteïene glikosileer is. Skaars modifikasies sluit in tirosinering / detirosinasie en poliglisilering van tubulien.
Een en dieselfde proteïen kan verskillende modifikasies ondergaan. Histone (proteïene wat deel uitmaak van chromatien in eukariote) onder verskillende toestande kan dus meer as 150 verskillende modifikasies ondergaan.
Na-translationele modifikasies word verdeel in:
- wysigings aan hoofstroombane,
- splitsing van die N-terminale metionienresidu,
- beperkte proteolise - verwydering van 'n proteïenfragment wat vanaf die ente kan voorkom (splitsing van seinvolgorde) of, in sommige gevalle, in die middel van die molekule (volwassenheid van insulien),
- die binding van verskillende chemiese groepe aan vrye amino- en karboksielgroepe (N-asilering, myristoylering, ens.),
- modifikasies van die sykettings van aminosure,
- die byvoeging of splitsing van klein chemiese groepe (glikosilering, fosforylering, ens.)
- die byvoeging van lipiede en koolwaterstowwe,
- verandering van standaard aminosuurresidue na nie-standaard (die vorming van sitrulline),
- die vorming van disulfied brûe tussen cysteïenreste,
- die byvoeging van klein proteïene (sumoylering en ubiquitinasie).
Intersellulêre vervoer en sorteer
Die proteïene wat in die sitoplasma van 'n eukariotiese sel gesintetiseer word, moet na verskillende selorganoïede vervoer word: die kern, mitochondria, endoplasmiese retikulum (EPR), Golgi-apparaat, lysosome, ens., En sommige proteïene moet die ekstrasellulêre medium binnedring. Om in 'n sekere gedeelte van die sel te beland, moet die proteïen 'n spesifieke etiket hê. In die meeste gevalle is so 'n etiket deel van die aminosuurvolgorde van die proteïen self (leierpeptied, of seinseekse van die proteïen), maar in sommige gevalle is die oligosakkariede wat aan die proteïen geheg is, die etiket.
Die vervoer van proteïene in die EPR word uitgevoer namate dit gesintetiseer word, aangesien ribosome wat proteïene met 'n seinvolgorde vir die EPR sintetiseer, sit op spesiale proteïene aan die buitenste membraan. Van die EPV na die Golgi-apparaat, en van daar na die lysosome en na die eksterne membraan of na die ekstrasellulêre medium, kom proteïene via vesikulêre transport in. Proteïene met 'n kernlokaliseringssein betree die kern deur kernpore. In mitochondria en chloroplaste, kom proteïene met die ooreenstemmende seinvolgorde deur spesifieke proteïenvertalerpore met deelname van chaperone.
Die instandhouding van struktuur en agteruitgang
Die korrekte ruimtelike struktuur van proteïene is baie belangrik vir hul normale funksionering. Verkeerde vou van proteïene wat tot die samevoeging daarvan lei, kan veroorsaak word deur mutasies, oksidasie, strestoestande of wêreldwye veranderinge in die fisiologie van die sel. Aggregering van proteïene is 'n kenmerkende teken van veroudering. Daar word geglo dat onbehoorlike proteïenvou die oorsaak of verergering van siektes soos sistiese fibrose, lysosomale opeenhopingsiekte is. sowel as neurodegeneratiewe afwykings (Alzheimers, Huntington en Parkinson).
In die proses van selevolusie is vier hoofmeganismes ontwikkel om proteïenaggregasie teen te werk. Die eerste twee - herhaalde vou (hervou) met behulp van chaperone en splitsing met proteases - word in bakterieë sowel as in hoër organismes aangetref. Outofagie en die ophoping van onbehoorlike gevoude proteïene in spesiale nie-membraanorganelle is kenmerkend van eukariote.

Die vermoë van proteïene om die korrekte driedimensionele struktuur na denaturering te herstel, stel ons in staat om te veronderstel dat alle inligting oor die finale struktuur van die proteïen in die aminosuursekwensie vervat is. Tans word die teorie dat die stabiele konformasie van 'n proteïen minimale vrye energie het, vergelyk met ander moontlike konformasies van hierdie polipeptied.
In selle is daar 'n groep proteïene waarvan die funksie is om die korrekte vou van ander proteïene te verseker na die sintese daarvan op die ribosoom, om die struktuur van proteïene na hul skade te herstel, sowel as die skepping en dissosiasie van proteïenkomplekse. Hierdie proteïene word chaperone genoem. Die konsentrasie van baie chaperone in die sel neem toe met 'n skerp toename in die omgewingstemperatuur, dus behoort hulle tot die Hsp-groep (Engelse hitteskokproteïene - hitteskokproteïene). Die belangrikheid van die normale werking van chaperones vir die funksionering van die liggaam kan geïllustreer word aan die hand van α-kristallien chaperone, wat deel uitmaak van die lens van die menslike oog. Mutasies in hierdie proteïen lei tot die samesmelting van die lens as gevolg van die versameling van proteïene en gevolglik katarakte.
As die tersiêre struktuur van proteïene nie herstel kan word nie, word dit deur die sel vernietig. Ensieme wat proteïene afbreek, word proteases genoem.Op die plek van die aanval van die substraatmolekule word proteolitiese ensieme verdeel in endopeptidases en exopeptidases:
- Endopeptidases, of proteïnases, splits peptiedbindings binne die peptiedketting. Hulle herken en bind kort peptiedvolgorde van substraat en hydroliseer die bindings tussen sekere aminosuurreste relatief spesifiek.
- Exopeptidases hydroliseer peptiede vanaf die uithoeke van die ketting: aminopeptidases vanaf die N-terminus, karboksypeptidases vanaf die C-terminus. Laastens splits dipeptidases slegs dipeptiede.
Volgens die katalisatiemeganisme identifiseer die International Union for Biochemistry and Molecular Biology verskeie klasse proteases, waaronder serienproteasies, asparagiese proteasen, cysteïne proteases, en metalloproteasen.
'N Spesiale soort protease is die proteasoom, 'n groot multisubunit protease wat in die kern en sitoplasma van eukariote, archaea en sommige bakterieë teenwoordig is.
Om die teikenproteïen deur die proteasoom gekloof te word, moet dit gemerk word deur 'n klein ubiquitienproteïne daaraan te heg. Die addisie-reaksie van ubiquitine word gekataliseer deur die ensieme ubiquitin ligases. Die toevoeging van die eerste ubiquitinemolekule aan die proteïen dien as 'n sein vir ligases vir die verdere toevoeging van ubiquitinemolekules. As gevolg hiervan word 'n polyubiquitineketting aan die proteïen geheg, wat aan die proteasoom bind en die splitsing van die teikenproteïen verseker. Oor die algemeen word hierdie stelsel ubiquitien-afhanklike proteïenafbraak genoem. Die afbraak van 80–90% van die intrasellulêre proteïene vind plaas met die deelname van die proteasoom.
Proteïendegradasie in peroxisome is belangrik vir baie sellulêre prosesse, insluitend die sel siklus, regulering van geenuitdrukking en reaksie op oksidatiewe spanning.

Outofagie is die proses van afbraak van biomolekules met 'n lang lewe, veral proteïene, sowel as organelle in lysosome (in soogdiere) of vakuole (in gis). Outofagie gaan gepaard met die belangrike aktiwiteit van enige normale sel, maar die gebrek aan voedingstowwe, die teenwoordigheid van beskadigde organelle in die sitoplasma en uiteindelik die teenwoordigheid van gedeeltelik gedenatureerde proteïene en hul aggregate in die sitoplasma kan dien as stimuli om die prosesse van outofagie in selle te verbeter.
Drie tipes autofagie word onderskei: mikro-autofagie, makro-autofagie, en chaperone-afhanklike outofagie.
Tydens mikroautofagie word makromolekules en fragmente van die selmembrane deur die lisosoom vasgevang. Op hierdie manier kan die sel proteïene verteer met 'n gebrek aan energie of boumateriaal (byvoorbeeld tydens honger). Die prosesse van mikroautofagie kom egter onder normale omstandighede voor en is meestal onoordeelkundig. Soms word organoïede ook verteer tydens mikroautofagie, byvoorbeeld, mikroautofagie van peroxisome en gedeeltelike mikroautofagie van kerne waarin die sel lewensvatbaar bly, word in giste beskryf.
In makroautofagie word 'n gedeelte van die sitoplasma (wat dikwels enige organoïede bevat) omring deur 'n membraankompartement soortgelyk aan 'n spoelbak van die endoplasmiese retikulum. As gevolg hiervan word hierdie plek deur twee membrane van die res van die sitoplasma geskei. Sulke dubbelmembraanorganelle word outofagosome genoem. Outofagosome smelt saam met lysosome en vorm outofofololososome waarin organelle en die res van die inhoud van outofagosome verteer word. Makro-outofagie is blykbaar ook nie-selektief, hoewel dit dikwels beklemtoon word dat die sel met behulp daarvan die organoïede kan ontslae raak wat "verouderd is" (mitochondria, ribosome, ens.).
Die derde tipe autofagie is afhanklik van chaperone. In hierdie metode vind gerigte vervoer van gedeeltelik gedenatureerde proteïene vanaf die sitoplasma deur die lisosoommembraan na die holte plaas waar dit verteer word. Hierdie soort outofagie, wat slegs by soogdiere beskryf word, word veroorsaak deur spanning.

JUNQ en IPOD
As 'n eukariotiese sel nie die ophoping van 'n groot aantal gedenatureerde proteïene kan hanteer nie, kan hulle onder spanning na een van twee soorte tydelike organelle gestuur word - JUNQ en IPOD (Engels) Russies. .
JUNQ (Eng. JUxta Nuclear Quality control compartment) hou verband met die buitekant van die kernmembraan en bevat ubiquitineerde proteïene wat vinnig na die sitoplasma kan oorgedra word, asook chaperone en proteasome. Die bedoelde funksie van JUNQ is om proteïene te refoldeer en / of af te breek.
IPOD (Engels onoplosbare proteïne deposito - 'n plek waar die onoplosbare proteïne neergelê word) is naby die sentrale vakuool geleë en bevat onbeweeglike aggregate van amyloïedvormende proteïene. Die ophoping van hierdie proteïene in die IPOD kan die interaksie daarvan met normale sellulêre strukture voorkom, daarom word voorgestel dat hierdie insluiting 'n beskermende funksie het.
Die funksies van proteïene in die liggaam
Soos ander biologiese makromolekules (polisakkariede, lipiede en nukleïensure), is proteïene noodsaaklike komponente van alle lewende organismes en speel dit 'n belangrike rol in die lewe van die sel. Proteïene voer metaboliese prosesse uit. Dit vorm deel van die intrasellulêre strukture - organelle en sitoskelet, wat in die ekstrasellulêre ruimte afgeskei word, waar hulle kan dien as 'n sein wat tussen selle oorgedra word, kan deelneem aan die hidrolise van voedsel en die vorming van 'n intercellulêre stof.
Die klassifikasie van proteïene volgens hul funksies is taamlik willekeurig, aangesien dieselfde proteïen verskeie funksies kan verrig. 'N Goed bestudeerde voorbeeld van sulke multifunksionaliteit is lysiel-tRNA-sintetase, 'n ensiem uit die klas van aminoasiel-tRNA-sintetases, wat nie net die lysienresidu aan tRNA heg nie, maar ook die transkripsie van verskillende gene reguleer. Proteïene verrig baie funksies as gevolg van hul ensiematiese aktiwiteit. Die ensieme is dus myosienmotoriese proteïene, regulerende proteïenkinase proteïene, vervoer proteïen natrium-kaliumadenosien trifosfatase, ens.

Katalitiese funksie
Die bekendste funksie van proteïene in die liggaam is die katalise van verskillende chemiese reaksies. Ensieme is proteïene wat spesifieke katalitiese eienskappe het, dit wil sê, elke ensiem kataliseer een of meer soortgelyke reaksies. Ensieme kataliseer die verdeling van komplekse molekules (katabolisme) en die sintese daarvan (anabolisme), insluitend DNA-replikasie en -herstel en matriks-RNA-sintese. In 2013 is meer as 5000 ensieme beskryf. Die versnelling van die reaksie as gevolg van ensiematiese katalise kan enorm wees: die reaksie wat deur die ensiem orotidine-5'-fosfaatdekarboksilase gekataliseer word, verloop byvoorbeeld 10 keer vinniger as die nie-gekataliseerde reaksie (die halfleeftyd van die dekarboksilering van orotiese suur is 78 miljoen jaar sonder die ensiem en 18 millisekondes). Molekules wat aan die ensiem heg en verander as gevolg van die reaksie, word substrate genoem.
Alhoewel ensieme gewoonlik uit honderde aminosuurresidue bestaan, is daar slegs 'n klein fraksie daarvan in interaksie met die substraat, en selfs kleiner hoeveelhede - gemiddeld 3-4 aminosuurresidue, wat dikwels ver van mekaar geleë is in die primêre struktuur - is direk betrokke by katalise. Die deel van die ensiemmolekule wat die binding van die substraat en katalise bied, word die aktiewe sentrum genoem.
In 1992 het die International Union of Biochemistry and Molecular Biology die finale weergawe van die hiërargiese nomenklatuur van ensieme voorgestel op grond van die tipe reaksies wat deur hulle gekataliseer is. Volgens hierdie nomenklatuur moet die name van ensieme altyd 'n einde hê -die basiese beginsels en vorm uit die name van die gekataliseerde reaksies en hul substraat. Aan elke ensiem word 'n individuele kode toegeken waardeur dit maklik is om die posisie in die hiërargie van ensieme te bepaal.Volgens die tipe gekataliseerde reaksies word alle ensieme in 6 klasse verdeel:
- CF 1: oksidoreduktase wat redoksreaksies kataliseer,
- CF 2: Transferases wat die oordrag van chemiese groepe van een substraatmolekule na 'n ander kataliseer,
- CF 3: Hidrolase wat die hidrolise van chemiese bindings kataliseer,
- CF 4: Lyases wat die verbreking van chemiese bindings sonder hidrolise kataliseer met die vorming van 'n dubbele binding in een van die produkte,
- CF 5: Isomerases wat strukturele of meetkundige veranderinge in die substraatmolekule kataliseer,
- CF 6: Ligases wat die vorming van chemiese bindings tussen substraat kataliseer weens hidrolise van die ATP-fosfaatbinding of 'n soortgelyke trifosfaat.
Strukturele funksie
Die struktuurproteïene van die sitoskelet, as 'n soort anker, gee vorm aan selle en baie organoïede en is betrokke by die verandering van die vorm van selle. Die meeste strukturele proteïene is filamentêr: aktien- en tubulienmonomere is byvoorbeeld bolvormige, oplosbare proteïene, maar na polimerisasie vorm dit lang drade wat die sitoskelet vorm, wat die sel in staat stel om vorm te behou. Kollageen en elastien is die belangrikste komponente van die tussen sellulêre stof van bindweefsel (byvoorbeeld kraakbeen), en hare, naels, voëlvere en sommige skulpe bestaan uit 'n ander keratienstruktuurproteïen.

Beskermende funksie
Daar is verskillende tipes beskermingsfunksies van proteïene:
- Fisiese beskerming. Fisieke beskerming van die liggaam word verskaf deur kollageen, 'n proteïen wat die basis vorm van die inter-sellulêre stof van bindweefsel (insluitend bene, kraakbeen, senings en diep lae van die vel (dermis)), keratien, wat die basis vorm van geil skilde, hare, vere, horings en ander afgeleides van die epidermis. Tipies word sulke proteïene as proteïene met 'n strukturele funksie beskou. Voorbeelde van proteïene van hierdie groep is fibrinogeen en trombien wat betrokke is by bloedstolling.
- Chemiese beskerming. Die binding van gifstowwe aan proteïenmolekules kan hul ontgifting bied. Lewerensieme speel 'n baie belangrike rol by ontgifting by mense wat gifstowwe afbreek of in 'n oplosbare vorm omskakel, wat bydra tot die vinnige eliminasie daarvan uit die liggaam.
- Immuun verdediging. Proteïene wat bloed en ander liggaamsvloeistowwe uitmaak, is betrokke by die liggaam se defensiewe reaksie op skade sowel as aanvalle van patogene. Proteïene van die komplementstelsel en teenliggaampies (immunoglobuliene) behoort tot die proteïene van die tweede groep, dit neutraliseer bakterieë, virusse of vreemde proteïene. Teenliggaampies wat deel uitmaak van die aanpasbare immuunstelsel, heg aan die stowwe wat vreemd is aan die liggaam, antigene en neutraliseer dit sodoende na die plekke van vernietiging. Teenliggaampies kan in die intersellulêre ruimte afgeskei word of in die membrane van gespesialiseerde B-limfosiete genoem word plasmosiete.
Regulerende funksie
Baie prosesse in die selle word gereguleer deur proteïenmolekules wat nie as energiebron of as boumateriaal vir die sel dien nie. Hierdie proteïene reguleer die bevordering van die sel in die selsiklus, transkripsie, translasie, splyting, die aktiwiteit van ander proteïene en baie ander prosesse. Proteïene verrig die regulatoriese funksie as gevolg van ensiematiese aktiwiteit (byvoorbeeld proteïenkinases) of as gevolg van spesifieke binding aan ander molekules. Transkripsiefaktore, aktiveerderproteïene en repressorproteïene, kan dus die transkripsie-intensiteit van gene reguleer deur te bind aan hul regulatoriese reekse. Op die vertaalvlak word die lees van baie mRNA's ook gereguleer deur die toevoeging van proteïenfaktore.
Die belangrikste rol in die regulering van intrasellulêre prosesse word deur proteïenkinases en proteïenfosfatases gespeel - ensieme wat die aktiwiteit van ander proteïene aktiveer of belemmer deur daaraan te heg of deur fosfaatgroepe uit te skakel.

Seinfunksie
Die seinfunksie van proteïene is die vermoë van proteïene om as seine te dien, om seine tussen selle, weefsels, organe en organismes oor te dra. Dikwels word die seinfunksie gekombineer met die regulerende een, aangesien baie intrasellulêre regulatoriese proteïene ook seine oordra.
Die seinfunksie word uitgevoer deur hormoonproteïene, sitokiene, groeifaktore, ens.
Hormone word deur bloed gedra. Die meeste dierehormone is proteïene of peptiede. Die binding van die hormoon aan die reseptor is 'n sein wat 'n selrespons veroorsaak. Hormone reguleer die konsentrasie van stowwe in die bloed en selle, groei, voortplanting en ander prosesse. 'N Voorbeeld van sulke proteïene is insulien, wat die konsentrasie van glukose in die bloed reguleer.
Selle is in wisselwerking met mekaar deur gebruik te maak van seinproteïene wat deur die intersellulêre stof oorgedra word. Sulke proteïene bevat byvoorbeeld sitokiene en groeifaktore.
Sitokiene is peptied-seine-molekules. Dit reguleer interaksies tussen selle, bepaal hul oorlewing, stimuleer of belemmer groei, differensiasie, funksionele aktiwiteit en apoptose, verseker die koördinering van die immuun-, endokriene en senuweestelsel. 'N Voorbeeld van sitokiene is die tumor-nekrose-faktor, wat inflammatoriese seine tussen die liggaamselle oordra.
Onderdele-funksie
Sulke proteïene bevat die sogenaamde reserwe-proteïene, wat as 'n bron van energie en stof in die saad van plante (byvoorbeeld 7S en 11S globuliene) en diere-eiers geberg word. 'N Aantal ander proteïene word in die liggaam as 'n bron van aminosure gebruik, wat op hul beurt voorlopers is van biologies aktiewe stowwe wat metaboliese prosesse reguleer.

Ontvangsfunksie
Proteïenreseptore kan beide in die sitoplasma geleë wees en in die selmembraan integreer. Een deel van die reseptormolekule ontvang 'n sein, wat meestal deur 'n chemiese stof bedien word, en in sommige gevalle ligte, meganiese spanning (byvoorbeeld strek) en ander stimuli. As 'n sein aan 'n spesifieke deel van die molekule - die reseptorproteïne - blootgestel word, vind die konformatoriese veranderinge plaas. As gevolg hiervan, verander die bouvorm van 'n ander deel van die molekule, wat 'n sein na ander sellulêre komponente stuur,. Daar is verskillende meganismes vir seinoordrag. Sommige reseptore kataliseer 'n sekere chemiese reaksie, ander dien as ioonkanale, wat die werking van 'n sein oopmaak of toemaak, terwyl ander spesifiek intrasellulêre bemiddelende molekules bind. By membraanreseptore is die deel van die molekule wat aan die seinmolekule bind, op die oppervlak van die sel, en is die domein wat die sein oordra binne-in.
Motoriese (motoriese) funksie
'N Hele klas motoriese proteïene bied liggaamsbewegings, byvoorbeeld spierkontraksie, insluitend beweging (myosien), beweging van selle binne die liggaam (byvoorbeeld amoeboïede beweging van leukosiete), beweging van cilia en flagella, asook aktiewe en gerigte intrasellulêre vervoer (kinesien, dyneïne) . Dyneïne en kinesiene vervoer molekules langs mikrotubules met behulp van ATP-hidrolise as energiebron. Dyneïne dra molekules en organelle oor vanaf die perifere dele van die sel na die sentrosoom, kinesiene - in die teenoorgestelde rigting. Dyneins is ook verantwoordelik vir die beweging van cilia en flagella van eukariote. Sitoplasmiese variante van myosien kan deelneem aan die vervoer van molekules en organelle deur mikrofilamente.
Proteïene in die metabolisme
Die meeste mikroörganismes en plante kan 20 standaardaminosure, sowel as addisionele (nie-standaard) aminosure, soos sitrulline, sintetiseer.Maar as aminosure in die omgewing is, bespaar selfs mikroörganismes energie deur aminosure in die selle te vervoer en hul biosintetiese weë af te skakel.
Aminosure wat nie deur diere gesintetiseer kan word nie, word noodsaaklik genoem. By die diere is die belangrikste ensieme in biosintetiese weë, byvoorbeeld aspartaatkinase, wat die eerste stap in die vorming van lisien, metionien en treonien kataliseer, kataliseer.
Diere kry hoofsaaklik aminosure van die proteïene wat in voedsel voorkom. Proteïene word tydens vertering vernietig, wat gewoonlik begin met die denaturering van die proteïen deur dit in 'n suur omgewing te plaas en dit te hydroliseer met behulp van ensieme genaamd proteases. Sommige aminosure wat as gevolg van vertering verkry word, word gebruik om liggaamsproteïene te sintetiseer, terwyl die res tydens glukoneogenese na glukose omgeskakel word of in die Krebs-siklus gebruik word. Die gebruik van proteïene as 'n energiebron is veral belangrik in die toestande van vas, wanneer die liggaam se eie proteïene, veral spiere, as energiebron dien. Aminosure is ook 'n belangrike bron van stikstof in die voeding van die liggaam.
Daar is geen verenigde standaarde vir menslike proteïeninname nie. Die mikroflora van die dikderm sintetiseer aminosure wat nie in ag geneem word by die bereiding van proteïennorme nie.
Studiemetodes
Die struktuur en funksies van proteïene word beide op gesuiwerde preparate bestudeer in vitro, en in hul natuurlike omgewing in 'n lewende organisme, in vivo. Studie van suiwer proteïene onder gekontroleerde toestande is nuttig vir die bepaling van hul funksies: kinetiese kenmerke van die katalitiese aktiwiteit van ensieme, relatiewe affiniteit vir verskillende substrate, ens. Proteïenstudies in vivo in selle of in organismes word addisionele inligting verskaf oor waar hulle funksioneer en hoe hul aktiwiteit gereguleer word.
Molekulêre en sellulêre biologie

Molekulêre en sellulêre biologiese metodes word gereeld gebruik om die sintese en lokalisering van proteïene in 'n sel te bestudeer. 'N Metode om lokalisering te bestudeer, word wyd gebruik, gebaseer op die sintese van 'n chimeriese proteïen in 'n sel, bestaande uit die bestudeerde proteïen, gekoppel aan 'n "verslaggewer", byvoorbeeld groen fluoresserende proteïen (GFP). Die ligging van so 'n proteïen in die sel kan met behulp van 'n fluoressensie-mikroskoop gesien word. Boonop kan proteïene gevisualiseer word met behulp van teenliggaampies wat hulle herken, wat weer 'n fluoresserende etiket dra. Terselfdertyd word die bekende proteïene van organelle soos die endoplasmatiese retikulum, Golgi-apparaat, lysosome en vakuole dikwels gevisualiseer, wat die lokalisering van die bestudeerde proteïen moontlik maak.
Immunohistochemiese metodes gebruik gewoonlik teenliggaampies wat gekonjugeer word met ensieme wat die vorming van 'n luminescerende of gekleurde produk kataliseer, waardeur u die lokalisering en hoeveelheid proteïene wat in die monsters bestudeer is, kan vergelyk. 'N Meer seldsame tegniek vir die bepaling van die ligging van proteïene is die ewewig-ultra-sentrifugasie van selfraksies in die gradiënt van sukrose of cesiumchloried.
Laastens is een van die klassieke metodes immuun-elektroniese mikroskopie, wat in wese soortgelyk is aan immunofluorescentie-mikroskopie, met die verskil dat 'n elektronmikroskoop gebruik word. Die monster word voorberei vir elektronmikroskopie, en dan verwerk met teenliggaampies teen 'n proteïen wat gekoppel is aan elektrondigte materiaal, gewoonlik goud.
Met behulp van terreingerigte mutagenese, kan navorsers die aminosuurvolgorde van 'n proteïen en gevolglik die ruimtelike struktuur daarvan, die ligging in die sel en die werking van die werking daarvan beïnvloed. Met behulp van hierdie metode, met behulp van gemodifiseerde tRNA's, kan kunsmatige aminosure ook in 'n proteïen ingebring word en proteïene met nuwe eienskappe gekonstrueer word.
Biochemiese
Om 'n ontleding te doen in vitro die proteïen moet van ander sellulêre komponente gesuiwer word. Hierdie proses begin gewoonlik met die vernietiging van selle en die sogenaamde selekstrak. Met behulp van sentrifugerings- en ultra-sentrifugeringsmetodes kan hierdie uittreksel verder verdeel word in: 'n fraksie wat oplosbare proteïene bevat, 'n fraksie wat membraanlipiede en proteïene bevat, en 'n fraksie wat sellulêre organelle en nukleïensure bevat.

Proteïne-neerslag deur uit te sout word gebruik om proteïnemengsels te skei, en dit maak ook proteïenkonsentrasie moontlik. Met sedimentasie-analise (sentrifugering) kan u proteïenmengsels fraksioneer volgens die waarde van die sedimentasie-konstant van individuele proteïene, gemeet in svedbergs (S). Daar word dan verskillende soorte chromatografie gebruik om die gewenste proteïen of proteïene te isoleer op grond van eienskappe soos molekulêre gewig, lading en affiniteit. Boonop kan proteïene geïsoleer word volgens hul lading met behulp van elektrofokus.
Om die proses van suiwering van proteïene te vereenvoudig, word genetiese manipulasie dikwels gebruik, waardeur u afgeleides van proteïene kan skep wat gerieflik is vir suiwering sonder om die struktuur of aktiwiteit daarvan te beïnvloed. "Etikette", wat klein aminosuurvolgordes is, byvoorbeeld 'n ketting van 6 of meer histidienreste, en is aan die een einde van die proteïen vasgeheg. Wanneer die uittreksel van die selle wat die 'gemerkte' proteïen sintetiseer, deur 'n chromatografiese kolom met nikkelione geslaag word, bind histidien met nikkel en bly dit op die kolom, terwyl die oorblywende bestanddele van die lysaat ongehinderd deur die kolom gaan (nikkel-chelaat-chromatografie). Baie ander etikette is ontwerp om navorsers te help om spesifieke proteïene van komplekse mengsels te isoleer, meestal met behulp van affiniteitschromatografie.
Die mate van proteïne-suiwering kan bepaal word as die molekulêre gewig en iso-elektriese punt daarvan bekend is - met behulp van verskillende soorte gelelektroforese - of deur ensimatiese aktiwiteit te meet as die proteïen 'n ensiem is. Met massaspektrometrie kan u die geselekteerde proteïen identifiseer volgens sy molekulêre gewig en die massa van sy fragmente.
Proteomika
Die totaliteit van selproteïene word 'n proteoom genoem, en die studie daarvan - proteomika, word analogies met genomika genoem. Belangrike eksperimentele proteomika-metodes sluit in:
- 2D elektroforese, wat die skeiding van multikomponent proteïenmengsels moontlik maak,
- massaspektrometrie, waardeur proteïene geïdentifiseer kan word deur die massa van hul samestellende peptiede met 'n hoë deurset,
- proteïen-mikroarrays, waarmee u gelyktydig die inhoud van 'n groot aantal proteïene in die sel kan meet,
- twee-baster gisstelsel , wat u toelaat om proteïen-proteïen-interaksies stelselmatig te bestudeer.
Die totaliteit van alle biologies-beduidende interaksies van proteïene in 'n sel word 'n interaksie genoem. 'N Sistematiese studie van die struktuur van proteïene wat alle moontlike tersiêre strukture verteenwoordig, word strukturele genomika genoem.
Struktuurvoorspelling en modellering
Voorspelling van ruimtelike struktuur met behulp van rekenaarprogramme (in silico) laat proteïenmodelle opbou waarvan die struktuur nog nie eksperimenteel bepaal is nie. Die suksesvolste soort struktuurvoorspelling, bekend as homologiese modellering, is afhanklik van die bestaande 'sjabloon'-struktuur, soortgelyk aan aminosuurvolgorde as die gesimuleerde proteïen. Die metodes om die ruimtelike struktuur van proteïene te voorspel, word gebruik in die ontwikkelende veld van genetiese manipulasie van proteïene, met behulp van nuwe tersiêre strukture van proteïene. 'N Meer ingewikkelde berekeningstaak is die voorspelling van intermolekulêre interaksies, soos molekulêre docking en die voorspelling van proteïen-proteïen interaksies.
Die vou en intermolekulêre interaksies van proteïene kan met behulp van molekulêre meganika gemodelleer word. veral molekulêre dinamika en die Monte Carlo-metode, wat toenemend voordeel trek uit parallelle en verspreide rekenaar (byvoorbeeld die Folding @ home-projek).Die vou van klein a-heliese proteïendomeine, soos villinproteïne of een van die HIV-proteïene, is suksesvol gemodelleer in silico. Met behulp van bastermetodes wat standaard molekulêre dinamika met kwantummeganika kombineer, is die elektroniese toestande van die visuele pigment rhodopsin ondersoek.