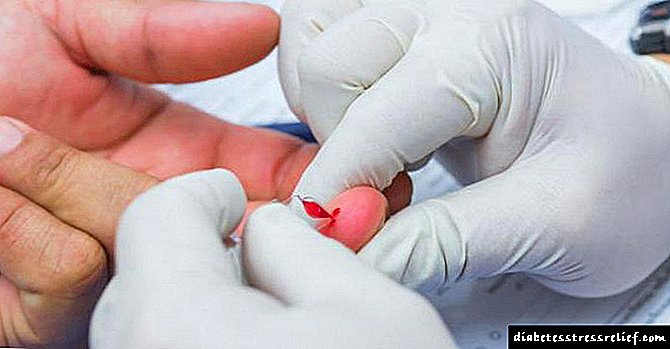
Cholesterolbiosintese en die biochemie daarvan - Diabetes
Sonder twyfel is cholesterol die bekendste lipied vir die algemene publiek; dit is berug as gevolg van die hoë korrelasie tussen hoë bloedcholesterol en die frekwensie van kardiovaskulêre siektes. Minder aandag is geskenk aan die belangrike rol van cholesterol as 'n komponent van selmembrane en as 'n voorloper vir steroïedhormone en galsure. Cholesterol is nodig vir baie diere, insluitend mense, maar die teenwoordigheid daarvan in soogdiervoedsel is opsioneel - liggaamselle kan dit self sintetiseer van eenvoudige voorgangers.
Die struktuur van hierdie 27-koolstofverbinding dui op 'n komplekse weg vir die biosintese daarvan, maar al sy koolstofatome word deur 'n enkele voorloper - asetaat voorsien. Isopreen blokke - die belangrikste tussenprodukte van asetaat tot cholesterol, dit is die voorgangers van baie natuurlike lipiede, en die meganismes waardeur isopreenblokke gepolymeriseer word, is soortgelyk in alle metaboliese weë.
Ons begin met die bestudering van die belangrikste stadiums in die weg van cholesterolbiosintese vanaf asetaat, en bespreek dan die vervoer van cholesterol deur die bloedstroom, die opname daarvan deur selle, die normale regulering van cholesterolsintese en regulering in gevalle van verswakte absorpsie of vervoer. Dan kyk ons na ander stowwe wat uit cholesterol kom, soos galsure en steroïedhormone. Laastens sal 'n beskrywing van die biosintetiese weë vir die vorming van baie verbindings - afgeleides van isopreenblokke, waarin daar vroeë stadiums met cholesterol-sintese bestaan, die buitengewone veelsydigheid van isoprenoïde kondensasie in biosintese illustreer.
Cholesterol word in vier fases uit asetiel-CoA vervaardig
Cholesterol word, soos langkettingvetsure, van asetiel-CoA vervaardig, maar die samestellingspatroon is heeltemal anders. In die eerste eksperimente is asetaat gemerk met 14 C óf by die metiel- óf karboksielkoolstofatoom by die veevoer gevoeg. Op grond van die verspreiding van die etiket in cholesterol wat van twee groepe diere geïsoleer is (Fig. 21-32), is die ensiematiese stadiums van cholesterolbiosintese beskryf.
Fig. 21-32. Bron van koolstofatome van cholesterol. Word tydens eksperimente geïdentifiseer met behulp van radioaktiewe asetaat gemerk met metielkoolstof (swart) of karboksielkoolstof (rooi). In die gekondenseerde struktuur word ringe aangedui met letters A tot D.

Die sintese vind plaas in vier fases, soos getoon in Fig. 21-33: (1) die kondensasie van drie asetaatreste om 'n ses-koolstof-tussengroep van mevalonaat te vorm, (2) die omskakeling van mevalonaat na geaktiveerde isopreenblokke, (3) die polimerisasie van ses vyf-koolstofisopreeneenhede om 'n 30-koolstof lineêre skwaleen te vorm, (4) siklisering van squaleen om te vorm vier ringe van die steroïedkern, gevolg deur 'n reeks veranderinge (oksidasie, verwydering of migrasie van metielgroepe) met die vorming van cholesterol.
Fig. 21-33. Algemene prentjie van cholesterolbiosintese. In die teks word vier fases van sintese bespreek. Isopreenblokke in squaleen word met rooi stippellyne gemerk.

Stadium (1). Sintese van mevalonaat uit asetaat. Die eerste fase van cholesterolbiosintese lei tot die vorming van 'n intermediêre produk mevalonaat (Fig. 21-34). Die twee asetiel CoA-molekules kondenseer om acetoasetiel CoA te gee, wat kondenseer met die derde asetiel CoA-molekule om 'n ses-koolstofverbinding te vorm ß-hidroksy-ß-metielglutaryl-CoA (HM G-COA). Hierdie twee eerste reaksies word gekataliseer thiolase en NM G-CoA-sintase, onderskeidelik. sitosoliese NM G-CoA sintase Hierdie metaboliese weg verskil van die mitochondriale iso-ensiem, wat die sintese van NM G-CoA kataliseer tydens die vorming van ketonliggame (sien Fig. 17-18).
Fig. 21-34. Die vorming van mevalonaat uit asetiel-CoA. Die bron van C-1 en C-2 mevalonaat van asetiel-CoA word in pienk gemerk.

Die derde reaksie beperk die snelheid van die hele proses. Daarin word NM G-COA gereduseer tot mevalonaat, waarvoor elk van die twee NА D PH-molekules twee elektrone voorsien. HMG-CoA reduktase - integrale membraanproteïen van gladde ER, dien dit, soos ons later sal sien, as die belangrikste punt van regulering van die metaboliese weg van cholesterolvorming.
Stadium (2). Die omskakeling van mevalonaat in twee geaktiveerde isopreen. Op die volgende stadium van cholesterolsintese word drie fosfaatgroepe van ATP-molekules na mevalonaat oorgedra (Fig. 21-35). Die fosfaat gebind aan die hidroksielgroep by C-3 mevalonaat in die tussentydse 3-fosfo-5-pyrofosfomevalonaat is 'n goeie vertrekgroep; in die volgende stap laat albei hierdie fosfate en die aangrensende karboksielgroep 'n dubbelbinding in die vyf-koolstofproduk ∆ 3 -isopenteniel pyrofosfaat. Dit is die eerste van twee geaktiveerde isopreenen - die belangrikste deelnemers aan cholesterol-sintese. Isomerisering van Δ 3-isopentenielpyrofosfaat gee 'n tweede geaktiveerde isopreen dimetielallyl pyrofosfaat. Die sintese van isopentenielpyrofosfaat in die sitoplasma van plantselle vind plaas volgens die pad wat hier beskryf word. Plantchloroplaste en baie bakterieë gebruik egter 'n pad onafhanklik van mevalonaat. Hierdie alternatiewe roete kom nie by diere voor nie, so dit is aantreklik as u nuwe antibiotika skep.
Fig. 21-35. Omskakeling van mevalonaat in geaktiveerde isopreenblokke. Die ses geaktiveerde eenhede vorm mekaar om squaleen te vorm (sien Figuur 21-36). Die vertrekgroepe van 3-fosfo-5-pyrofosfomevalonaat word in pienk uitgelig. In vierkantige hakies is 'n hipotetiese tussenproduk.

Stadium (3). Kondensasie van ses geaktiveerde isopreeneenhede om squaleen te vorm. Isopenteniel-pyrofosfaat en dimetielallyl-pirofosfaat ondergaan nou kop-tot-stert kondensasie, waarin een pyrofosfaatgroep beweeg en 'n ketting van 10 koolstof vorm - geranyl pyrofosfaat (Fig. 21-36). (Pyrofosfaat heg aan die kop vas.) Geranyl pyrofosfaat ondergaan die volgende kop-tot-stert kondensasie met isopenteniel pyrofosfaat, en 'n 15-koolstof tussentyd vorm farnesiel pyrofosfaat. Laastens kombineer die twee molekules farnesiel pyrofosfaat “kop aan kop”, beide fosfaatgroepe word verwyder - gevorm squalene.
Fig. 21-36. Squaleenvorming. 'N Squaleenstruktuur wat 30 koolstofatome bevat, kom voor tydens opeenvolgende kondensasies wat deur isopreenblokke (vyfkoolstofblokke) geaktiveer word.

Die algemene name vir hierdie tussenprodukte kom van die name van die bronne waaruit hulle eers geïsoleer is. Geraniol, 'n bestanddeel van roosolie, het 'n geraniumsgeur, en farnesol, gevind in die kleure van die acacia farnesa, het 'n lelie van die vallei-aroma. Baie natuurlike plantgeure behoort aan verbindings wat van isopreenblokke gebou is. Squaleen, wat eers van die haai lewer (Squalus spesies) geïsoleer is, bestaan uit 30 koolstofatome: 24 atome in die hoofketting en ses atome in die metaalubstituente.
Stadium (4). Transformasie van squaleen in vier ringe van 'n steroïde kern. In fig. 21-37 is dit duidelik dat die skyfale kettingstruktuur en sterole - siklies is. Alle sterole het vier gekondenseerde ringe wat die steroïedkern vorm, en almal is alkohole met 'n hidroksielgroep by die C-3-atoom, vandaar die Engelse naam sterol. Onder aksie squaleen monooxygenase een suurstofatoom van O word aan die einde van die squaleenketting gevoeg 2 en 'n epoksied word gevorm. Hierdie ensiem is nog 'n gemengde-funksie oksidase (voeg by 21-1), NADPH verminder nog 'n suurstofatoom van O 2 aan H2 O. Produk dubbele bande squalene-2,3-epoksied so gerangskik dat 'n merkwaardig konsekwente reaksie 'n ketting squaleen-epoksied in 'n sikliese struktuur kan omskep. In dierselle lei hierdie siklisering tot die vorming van lanosterol, wat vier ringe bevat wat kenmerkend is van die steroïedkern. As gevolg hiervan word lanosterol omgeskakel in cholesterol deur 'n reeks van ongeveer 20 reaksies, wat die migrasie van sommige metaalgroepe en die verwydering van ander insluit. In die laat vyftigerjare is Conrad Bloch, Theodore Linen, John Cornfort en George Popiak in Conrad Bloch, Theodore Linen, John Cornfort en George Popiak beskryf.
Fig. 21-37. Ringsluiting verander lineêre squaleen in 'n gekondenseerde steroïedkern. Die eerste fase word gekataliseer deur 'n oksidase met 'n gemengde funksie (monooxygenase), waarvan die kosubstraat N AD PH is. Die produk is 'n epoksied wat in die volgende fase fietseer om 'n steroïedkern te vorm. Die finale produk van hierdie reaksies in dierselle is cholesterol; in ander organismes word sterole effens anders as dit gevorm.


Cholesterol is 'n sterol kenmerk van dierselle, plante, swamme en protiste produseer ander baie soortgelyke sterole.
Hulle gebruik dieselfde sintese-roete na squaleen-2,3-epoxide, maar dan wyk die paadjies effens uiteen, en ander sterole word gevorm, soos sigmasterol in baie plante en ergosterol in swamme (Fig. 21-37).
Voorbeeld 21-1 Energiekoste vir Squaleen-sintese
Wat is die energiekoste (uitgedruk as ATP-molekules) vir die sintese van een squaleenmolekule?
Besluit. By die sintese van squaleen uit asetiel-CoA word ATP slegs spandeer op die stadium wanneer mevalonaat omgeskakel word in 'n geaktiveerde isopreen-squaleenvoorloper. Ses geaktiveerde isopreen-molekules is nodig om 'n squaleenmolekule te bou, en drie ATP-molekules is nodig om elke geaktiveerde molekule te vervaardig. In totaal word 18 ATP-molekules bestee aan die sintese van een squaleenmolekule.
Verbindings van cholesterol in die liggaam
In gewerweldes word groot hoeveelhede cholesterol in die lewer gesintetiseer. Sommige van die cholesterol wat daar gesintetiseer word, word in die membrane van hepatosiete opgeneem, maar dit word hoofsaaklik in een van die drie vorme daarvan uitgevoer: gal-cholesterol, galsure of cholesterolesters. Galsure en hul soute is hidrofiliese derivate van cholesterol, wat in die lewer gesintetiseer word en bydra tot die vertering van lipiede (sien Fig. 17-1). Esters van cholesterol gevorm deur die werking van die lewer asiel-CoA-cholesterol-asieltransferase (ACAT). Hierdie ensiem kataliseer die oordrag van 'n vetsuurresidu van koënsiem A na die hidroksielgroep cholesterol (Fig. 21-38), wat cholesterol in 'n meer hidrofobiese vorm verander. Cholesterolesters in afgeskeie lipoproteïne deeltjies word met behulp van cholesterol na ander weefsels vervoer of in die lewer geberg.
Fig. 21-38. Sintese van cholesterolesters. Etherifikasie maak cholesterol 'n nog meer hidrofobiese vorm vir berging en vervoer.

Cholesterol is nodig vir alle weefsels van 'n groeiende dierlike organisme vir die sintese van membrane, en sommige organe (byvoorbeeld die byniere en geslagskliere) gebruik cholesterol as 'n voorloper vir steroïedhormone (dit word hieronder bespreek). Cholesterol is ook 'n voorloper vir vitamien D (sien Figuur 10-20, vers 1).
Cholesterol en ander lipiede bevat plasmalipoproteïene
Cholesterol- en cholesterolesters, soos triasielglycerole en fosfolipiede, is prakties onoplosbaar in water, maar hulle moet van die weefsel waarin dit gesintetiseer is, beweeg na die weefsel waar dit geberg of verbruik sal word. Dit word deur die bloedstroom gedra in die vorm van bloedplasmalipoproteïene - makromolekulêre komplekse van spesifieke draproteïene (Apolipoproteins) met fosfolipiede, cholesterol, cholesterolesters en triasielgliserole teenwoordig in hierdie komplekse in verskillende kombinasies.
Apolipoproteïne (“apo” verwys na die lipiedvrye proteïen self) kombineer met lipiede om verskillende fraksies van lipoproteïendeeltjies te vorm - sferiese komplekse met hydrofobe lipiede in die middel en hydrofiele aminosuurkettings op die oppervlak (Fig. 21-39, a). Met verskillende kombinasies van lipiede en proteïene word deeltjies van verskillende digthede gevorm - van chilomikrone tot lipoproteïene met 'n hoë digtheid. Hierdie deeltjies kan geskei word deur ultra-sentrifugering (Tabel 21-1) en visueel waargeneem word met behulp van elektronmikroskopie (Figuur 21-39, b). Elke fraksie van lipoproteïne verrig 'n spesifieke funksie, wat bepaal word deur die plek van sintese, lipiedsamestelling en apolipoproteïeninhoud. Minstens 10 verskillende apolipoproteïene is in plasma van menslike bloed aangetref (Tabel 21-2), wat wissel in grootte, reaksies met spesifieke teenliggaampies, en die kenmerkende verdeling in verskillende klasse lipoproteïene. Hierdie proteïenkomponente dien as seinstowwe wat lipoproteïene op spesifieke weefsels rig of as ensieme wat op lipoproteïene werk, aktiveer.
Tabel 21-1. Menslike plasmalipoproteïene
Samestelling (massa fraksie,%)
r = 513,000). 'N Deeltjie van LDL bevat 'n kern van ongeveer 1500 molekules cholesterolesters, rondom die kern is daar 'n dop van 500 molekules cholesterol, 800 molekules fosfolipiede en een molekule apoB-100. b - vier klasse lipoproteïene, sigbaar met 'n elektronmikroskoop (na die manifestasie van negatief). Kloksgewys, vanaf die linkerboven figuur: chilomikrone - met 'n deursnee van 50 tot 200 nm, PL O NP - van 28 tot 70 nm, HDL - van 8 tot 11 nm, en LDL - van 20 tot 55 nm. Die eienskappe van lipoproteïene word in tabel gegee. 21-2.

chilomikrone, bedoel in Art. 17, voer triasielglycerole van die derm na ander weefsels. Dit is die grootste lipoproteïene, hulle het die laagste digtheid en die hoogste relatiewe inhoud van triasielglycerole (sien Fig. 17-2). Chilomikrone word gesintetiseer in die ER van epiteelselle wat die dunderm beloer, en beweeg dan deur die limfstelsel en gaan die bloedstroom binne deur die linker subklaviese aar. Chylomicron apolipoproteïne bevat apoB-48 (uniek vir hierdie klas lipoproteïene), apoE en apoC-II (Tabel 21-2). AroC-II aktiveer lipoproteïne-lipase in die kapillêres van vetweefsel, hart-, skeletspier en lakterende melkkliere, wat die vloei van vrye vetsure na hierdie weefsels verseker. Dus dra chilomikrone voedselvetsure na weefsels oor, waar dit verbruik word of as brandstof geberg word (Fig. 21-40). Chylomicron-residue (hoofsaaklik bevry van triasielglycerole, maar steeds cholesterol, apoE en apoB-48) word deur die bloedstroom na die lewer vervoer. In die lewer bind reseptore aan apoE wat in chylomicron-residue bevat word, en bemiddel die absorpsie daarvan deur endositose. By hepatosiete stel hierdie residue die cholesterol vry wat hulle bevat en word dit in lysosome vernietig.
Tabel 21-2. Menslike plasmalipoproteïne-apolipoproteïene
Funksie (indien bekend)
Aktiveer L CAT, is in wisselwerking met ABC-vervoerder
Inhibeer L CAT
Aktiveer L CAT, cholesterolvervoer / opruiming
Bind aan LDL-reseptor
Chilomikrone, VLDL, HDL
Chilomikrone, VLDL, HDL
Chilomikrone, VLDL, HDL
Begin opruiming van VLDL en chylomicronreste
As voedsel meer vetsure bevat as wat dit tans as brandstof kan gebruik, word dit triasielglycerole in die lewer, wat 'n fraksie vorm met spesifieke apolipoproteïene lipoproteïene met baie lae digtheid (VLDL). Oormatige koolhidrate in die lewer kan ook omgeskakel word na triasielglycerole en uitgevoer word as VLDL (Fig. 21-40, a).Benewens triasielglycerole, bevat die VLDL-fraksie 'n sekere hoeveelheid cholesterol en cholesterolesters, sowel as apoB-100, apoC-1, apoC-II, apoC III en apoE (Tabel 21-2). Hierdie lipoproteïene word ook deur bloed vanaf die lewer na spier- en vetweefsel vervoer, waarna, na lipoproteïne-lipase deur apo-C II geaktiveer word, vrye vetsure vrygestel word van triasielglycerole van die VLDL-fraksie. Adiposiete vang vrye vetsure op, verander dit weer in triasielglycerole, wat in hierdie selle gestoor word in die vorm van lipiede insluitings (druppels); miosiete, inteendeel, oksideer onmiddellik vetsure om energie op te wek. Die meeste VLDL-residue word deur hepatosiete uit die sirkulasie geëlimineer. Die absorpsie daarvan, soortgelyk aan die absorpsie van chilomikrone, word deur reseptore bemiddel en hang af van die teenwoordigheid van apoE in VLDL-residue (addisioneel 21-2 word die verband tussen apoE en Alzheimersiekte beskryf).
Fig. 21-40. Lipoproteïene en lipiedtransport, en - lipiede word deur die bloedstroom vervoer in die vorm van lipoproteïene, wat gekombineer word in verskillende breuke met verskillende funksies en verskillende samestellings van proteïene en lipiede (tab. 21-1, 21-2) en stem ooreen met die digtheid van hierdie breuke. Voedsellipiede word saamgevoeg in chilomikrone, en die meeste triasielglycerole wat daarin voorkom, word deur lipoproteïne-lipase in vet- en spierweefsel in die kapillêre vrystellings vrygestel. Chylomikronreste (wat hoofsaaklik proteïen en cholesterol bevat) word deur hepatosiete gevang. Endogene lipiede en cholesterol uit die lewer word aan vet- en spierweefsel in die vorm van VLDL oorgedra. Die vrystelling van lipiede vanaf VLDL (saam met die verlies van sommige apolipoproteïene) skakel VLDLP geleidelik om na LDL, wat cholesterol in ekstrahepatiese weefsels lewer of dit na die lewer teruggee. Die lewer vang die oorblyfsels van VLDL, LDL en die oorblyfsels van chilomicron deur reseptor-gemedieerde endositose. Oormatige cholesterol in ekstrahepatiese weefsels word teruggevoer na die lewer in die vorm van LDL. In die lewer word 'n deel van die cholesterol in galsoute. b - bloedplasmamonsters geneem na die honger (links) en na die eet van voedsel met 'n hoë vetinhoud (regs). Chilomikrone gevorm deur vetterige kos te eet, gee die plasma 'n eksterne ooreenkoms met melk.

Met die verlies van triacylglycerols, word 'n gedeelte van VLDL omgeskakel na VLDL-residue, ook genoem intermediêre digtheid lipoproteïne (VLDL), wat verdere verwydering van triacylglycerols uit VLDL gee lae-digtheid lipoproteïene (LDL) (tab. 21-1). Die LDL-fraksie, wat baie ryk aan cholesterol- en cholesterolesters is, en ook apoB-100 bevat, dra cholesterol oor na ekstrahepatiese weefsels wat spesifieke reseptore bevat wat apoB-100 op hul plasmamembrane herken. Hierdie reseptore bemiddel die opname van cholesterol en cholesterolesters (soos hieronder beskryf).
Byvoeging 21-2.ApoE-allele bepaal die voorkoms van Alzheimersiekte
In die menslike bevolking is daar drie bekende variante (drie allele) van die geen wat apolipoproteïen E kodeer. Van die apoE-allele is die APOEZ-allel die algemeenste by mense (ongeveer 78%), die APOE4- en APOE2-allele is onderskeidelik 15 en 7%. Die APOE4-allel is veral kenmerkend vir mense met Alzheimer-siekte, en hierdie verwantskap kan die voorkoms van die siekte met 'n groot waarskynlikheid voorspel. Mense wat APOE4 geërf het, het 'n groot risiko om laat Alzheimersiekte te ontwikkel. Mense wat homosigoties is vir APOE4, is 16 keer meer geneig om die siekte te ontwikkel, die gemiddelde ouderdom van diegene wat siek word, is ongeveer 70 jaar oud. Inteendeel, mense wat twee kopieë van AROEZ erf, is die gemiddelde ouderdom van Alzheimersiekte meer as 90 jaar.
Die molekulêre basis vir die assosiasie tussen apoE4 en Alzheimersiekte is nog onbekend. Daarbenewens is dit nog onduidelik hoe apoE4 die groei van amyloïdkoorde, wat blykbaar die oorsaak van Alzheimer se siekte is, kan beïnvloed (sien Fig. 4-31, vers 1). Aannames fokus op die moontlike rol van apoE in die stabilisering van die struktuur van die sitoskelet van neurone. Die apoE2- en apoEZ-proteïene bind aan 'n aantal proteïene wat verband hou met mikrotubulêre neurone, terwyl apoE4 nie bind nie. Dit kan die dood van neurone versnel. Wat ook al hierdie meganisme is, hierdie waarnemings gee hoop om ons begrip van die biologiese funksies van apolipoproteïene uit te brei.
Die vierde tipe lipoproteïene - lipoproteïene met hoë digtheid (HDL), hierdie fraksie word gevorm in die lewer en dunderm in die vorm van klein proteïenryke deeltjies wat relatief min cholesterol bevat en heeltemal vry van cholesterolesters (Fig. 21-40). Die HDL-fraksie bevat apoA-I, apoC-I, apoC-II en ander apolipoproteïene (Tabel 21-2), asook lesitien-cholesterol-asieltransferase (LC AT), wat die vorming van cholesterolesters van lesitien (fosfatidylcholien) en cholesterol kataliseer (Fig. 21-41). L CAT op die oppervlak van nuut gevormde HDL-deeltjies omskep die chylomicroncholesterol en fosfatidylcholien- en VLDL-residue in cholesterolesters, wat die kern begin vorm, wat die nuut gevormde discoïde HDL-deeltjies omskakel in volwasse sferiese HDL-deeltjies. Hierdie cholesterolryke lipoproteïne word dan na die lewer teruggebring, waar cholesterol “vrygestel” word, en sommige van hierdie cholesterol word in galsoute omgeskakel.
Fig. 21-41. Die reaksie gekataliseer deur lesitien-cholesterol-asieltransferase (L CAT). Hierdie ensiem is teenwoordig op die oppervlak van HDL-deeltjies en word geaktiveer deur apoA-1 ('n komponent van die HDL-fraksie). Cholesterolesters versamel in die nuutgevormde HDL-deeltjies en word dit tot volwasse HDL.

HDL kan deur die reseptor-gemedieerde endositose in die lewer opgeneem word, maar ten minste word sommige van die HDL-cholesterol deur ander meganismes aan ander weefsels oorgedra. HDL-deeltjies kan bind aan SR-BI-reseptorproteïene op die plasmamembraan van lewerselle en in steroïdogene weefsel, soos die byniere. Hierdie reseptore bemiddel nie endositose nie, maar gedeeltelike en selektiewe oordrag van cholesterol en ander lipiede van die HDL-fraksie in die sel. Die 'uitgeputte' HDL-fraksie gaan dan weer in die bloedstroom, waar dit nuwe porsies lipiede van chylomikrone en VLDL-residue insluit. Dieselfde HDL kan ook cholesterol vang wat in ekstrahepatiese weefsels gestoor word en dit na die lewer oordra omgekeerde cholesterol vervoer (Fig. 21-40). In een van die omgekeerde transportvariante, veroorsaak die interaksie van die resulterende HDL met SR-BI-reseptore in cholesterolryke selle die passiewe diffusie van cholesterol vanaf die celoppervlak na HDL-deeltjies, wat dan cholesterol terug na die lewer oordra. In 'n ander variant van omgekeerde vervoer in 'n ryk cholesterolsel, reageer apoA-I met die aktiewe vervoerder, ABC-proteïen, na die splitsing van HDL. ApoA-I (en vermoedelik HDL) word deur endositose opgeneem, dan weer afgeskei, gelaai met cholesterol, wat na die lewer vervoer word.
Proteïne ABC1 is deel van 'n groot familie draers van baie geneesmiddels. Hierdie draers word soms ABC-vervoerders genoem, aangesien hulle almal ATP-bindende kassette bevat (ATP - bindende kassette), hulle het ook twee transmembraandomeine met ses transmembraanhelms (sien hfst. 11, vers 1). Hierdie proteïene dra baie ione, aminosure, vitamiene, steroïedhormone en galsoute aktief deur plasmamembrane oor. 'N Ander verteenwoordiger van hierdie familie draers is die CFTR-proteïen, wat met sistiese fibrose beskadig is (sien add. 11-3, vers 1).
Cholesterolesters betree die sel deur reseptor-gemedieerde endositose
Elke LDL-deeltjie in die bloedstroom bevat apoB-100, wat erken word deur spesifieke oppervlakreseptorproteïene -LDL-reseptore op die membraan van selle wat cholesterol moet vang. Die binding van LDL aan die LDL-reseptor begin endositose, waardeur LDL en die reseptor daarvan binne-in die endosoom in die sel beweeg (Fig. 21-42). Die endosoom versmelt uiteindelik met die lysosoom, wat ensieme bevat wat cholesterolesters hidroliseer, wat cholesterol en vetsure in die sitosol vrystel. ApoB-100 van LDL breek ook af om aminosure te vorm wat in die sitosol afgeskei word, maar die LDL-reseptor vermy agteruitgang en keer terug na die seloppervlak om weer aan die LDL-opname deel te neem. ApoB-100 is ook in VLDL aanwesig, maar die reseptor-bindende domein kan nie aan die LDL-reseptor bind nie; die omskakeling van VLDLP na LDL maak die reseptor-bindende domein in apoB-100 toeganklik. Hierdie bloedcholesterolvervoerweg en die reseptor-gemedieerde endositose in teikenweefsel is deur Michael Brown en Joseph Goldstein bestudeer.
Michael Brown en Joseph Goldstein

Fig. 21-42. Vang van cholesterol deur reseptormedieerde endositose.

Cholesterol, wat op hierdie manier die selle binnekom, kan in membrane opgeneem word of deur estaat herverester word (Fig. 21-38) om in die sitosol binne-in lipieddruppels op te berg. As daar genoeg cholesterol in die LDL-fraksie van bloed beskikbaar is, word die ophoping van oortollige intrasellulêre cholesterol voorkom deur die tempo van die sintese daarvan te verminder.
Die LDL-reseptor bind ook aan apoE en speel 'n belangrike rol in die opname van chilomikrone en VLDL-residue deur die lewer. As LDL-reseptore egter nie beskikbaar is nie (soos byvoorbeeld in 'n muisstam met 'n ontbrekende LDL-reseptorgeen), word VLDL-residue en chilomikrone steeds deur die lewer opgeneem, hoewel LDL nie geabsorbeer word nie. Dit dui op die teenwoordigheid van 'n hulpreserwe-stelsel vir reseptor-bemiddelde endositose van VLDL en chylomicron residue. Een van die reseptore is die LRP-proteïen (lipoproteïne-reseptor-verwante proteïen), wat verband hou met lipoproteïne-reseptore, wat bind aan apoE en 'n aantal ander ligande.
Verskeie vlakke van regulering van die biosintese van cholesterol
Cholesterolsintese is 'n ingewikkelde en energiek duur proses, dus dit is duidelik dat die liggaam voordelig is om 'n meganisme te hê om die biosintese van cholesterol te reguleer, wat die hoeveelheid aanvullend tot die voedsel wat dit bevat, aanvul. By soogdiere word cholesterolproduksie gereguleer deur intrasellulêre konsentrasie
cholesterol en hormone glukagon en insulien. Die stadium van omskakeling van HMG - CoA na mevalonate (Fig. 21-34) beperk die snelheid in die metaboliese weg van cholesterolvorming (die belangrikste punt van regulering). Hierdie reaksie word gekataliseer deur HMG - CoA reduktase. Regulering in reaksie op veranderinge in cholesterolvlakke word bemiddel deur 'n elegante transkripsionele reguleringstelsel vir 'n geen wat HMG - CoA-reduktase kodeer. Hierdie geen, tesame met meer as 20 ander gene wat kodeer vir ensieme wat betrokke is by die absorpsie en sintese van cholesterol en onversadigde vetsure, word beheer deur 'n klein familie proteïene genaamd proteïene wat in wisselwerking is met die sterolregulerende element van proteïenvorming (SREBP, sterol regulerende element bindende proteïene) . Na sintese word hierdie proteïene in die endoplasmiese retikulum ingevoer. Die enigste oplosbare aminoterminale SREBP-domein funksioneer as 'n transkripsie-aktivator met behulp van die meganismes wat in Ch. 28 (vers 3). Hierdie domein het egter nie toegang tot die kern nie en kan nie aan die aktivering van die geen deelneem nie, solank dit in die SREBP-molekule bly. Om transkripsie van die HMG-geen - CoA-reduktase en ander gene te aktiveer, word die transkripsioneel aktiewe domein deur proteolitiese splitsing van die res van SREBP geskei. As cholesterol hoog is, is SREBP-proteïene onaktief, word dit op 'n ER vasgemaak in 'n kompleks met 'n ander proteïen genaamd SCAP (SREBP - proteïne wat die splitsing aktiveer) (Fig. 21-43). Dit is SCAP wat cholesterol en 'n aantal ander sterole bind, wat as 'n sterolsensor optree. As die sterolvlak hoog is, is die SCAP-SREBP-kompleks waarskynlik in wisselwerking met 'n ander proteïen, wat die hele kompleks in die ER hou. Wanneer die vlak van sterole in die sel daal, lei die konformasieverandering in SCAP tot 'n verlies aan retensie-aktiwiteit, en die SCAP-SREBP-kompleks migreer binne die vesikels na die Golgi-kompleks. In die Golgi-kompleks word SREBP-proteïene twee keer gekloof deur twee verskillende proteases, terwyl die tweede splitsing die aminoterminaal domein in die sitosol vrystel. Hierdie domein beweeg na die kern en aktiveer die transkripsie van teikengene. Die aminoterminale SREBP proteïen domein het 'n kort halfleeftyd en word vinnig deur proteasome afgebreek (sien Fig. 27-48, t. 3). As die sterolvlak voldoende styg, word die proteolitiese vrystelling van die SR EBP-proteïendomeine met die aminoterminal weer geblokkeer, en die proteasoom-agteruitgang van bestaande aktiewe domeine lei tot 'n vinnige afskakeling van die teikengene.
Fig. 21-43. Aktivering van SR EBP. SREB P-proteïene wat onmiddellik met sintese in wisselwerking is met 'n sterol-gereguleerde element (groen kleur), word in die ER ingebring en vorm 'n kompleks met S CAP (rooi kleur). (N en C dui die amien- en karboksiel-ente van die proteïene aan.) In die S-CAP-gebonde toestand is SRE BP-proteïene onaktief. As die sterolvlak daal, migreer die SR EBP-S CAP-kompleks na die Golgi-kompleks, en word die SR EBP-proteïene opeenvolgend gekloof deur twee verskillende proteases. Die bevryde aminosuur terminale SR EBP proteïen domein migreer na die kern, waar dit die transkripsie van sterol-gereguleerde gene aktiveer.

Cholesterolsintese word ook deur verskeie ander meganismes gereguleer (Fig. 21-44). Hormonale beheer word bemiddel deur die kovalente modifikasie van NM G-CoA reduktase. Hierdie ensiem bestaan in gefosforyleerde (onaktiewe) en gedefosforyleerde (aktiewe) vorms. Glukagon stimuleer die fosforylering (inaktivering) van die ensiem, en insulien bevorder defosforylering, aktiveer die ensiem en bevoordeel die sintese van cholesterol. Hoë intrasellulêre konsentrasies van cholesterol aktiveer ASAT, wat die verestering van cholesterol vir afsetting verhoog. Laastens belemmer hoë vlakke van sellulêre cholesterol die transkripsie van 'n geen wat vir 'n LDL-reseptor kodeer, wat die produksie van hierdie reseptor verminder, en die opname van cholesterol uit die bloed.
Fig. 21-44. Die regulering van cholesterolvlakke sorg vir 'n balans tussen die sintese en absorpsie van cholesterol uit voedsel. Glucagon vergemaklik fosforylering (inaktivering) van NM G-COA-reduktase, insulien bevorder defosforilering (aktivering). X - ongeïdentifiseerde cholesterolmetaboliete wat proteolise van NM G-CoA reduktase stimuleer.

Ongereguleerde cholesterol kan tot ernstige siektes by mense lei. Wanneer die totale hoeveelheid gesintetiseerde cholesterol en cholesterol wat uit voedsel verkry word, meer is as die hoeveelheid wat benodig word vir membraanmontering, sintese van galsoute en steroïede, kan patologiese ophopings van cholesterol in bloedvate (aterosklerotiese gedenkplate) verskyn, wat kan lei tot die verstopping daarvan (aterosklerose). In geïndustrialiseerde lande is dit hartversaking as gevolg van obstruksie van die kransslagare wat die grootste oorsaak van sterftes is. Die ontwikkeling van aterosklerose word geassosieer met hoë vlakke van bloedcholesterol en veral met hoë cholesterol wat deur die LDL-fraksie verdra word; hoë HDL-bloedvlakke, inteendeel, beïnvloed die toestand van bloedvate gunstig.
Met oorerflike hipercholesterolemie ('n genetiese afwyking) is die vlak van bloedcholesterol baie hoog - erge aterosklerose ontwikkel by hierdie mense al in die kinderjare. As gevolg van 'n gebrekkige LDL-reseptor, vind 'n onvoldoende opname van die reseptor-gemedieerde opname van LDL-cholesterol plaas. As gevolg hiervan word cholesterol nie uit die bloedstroom verwyder nie, dit versamel en dra by tot die vorming van aterosklerotiese gedenkplate. Die sintese van endogene cholesterol duur voort, ondanks die oortollige cholesterol in die bloed, aangesien ekstrasellulêre cholesterol nie in die sel kan beland om intrasellulêre sintese te reguleer nie (Fig. 21-44).Vir die behandeling van pasiënte met oorerflike hipercholesterolemie en ander siektes wat verband hou met verhoogde serumcholesterol, word statinklasse gebruik. Sommige daarvan is van natuurlike bronne verkry, terwyl ander deur die farmaseutiese industrie gesintetiseer is. Statiene is soortgelyk aan mevalonaat (add. 21-3) en is mededingende remmers van NMS-CoA-reduktase.
Bylae 21-3. Medisyne. Die lipiedhipotese en die vorming van statiene
Koronêre hartsiektes (CHD) is die belangrikste oorsaak van sterftes in ontwikkelde lande. Die vernouing van die bloedvate wat bloed na die hart vervoer, vind plaas as gevolg van die vorming van vetterige afsettings genaamd aterosklerotiese gedenkplate; hierdie gedenkplate bevat cholesterol, fibrillêre proteïene, kalsium, bloedplaatjieklonte en selfragmente. In die XX eeu. Daar was aktief debatte oor die verband tussen arteriële obstruksie (aterosklerose) en bloedcholesterol. Hierdie besprekings en aktiewe navorsing in hierdie rigting het gelei tot die skepping van effektiewe medisyne wat cholesterol verlaag.
In 1913 het N.N. Anichkov, 'n bekende Russiese wetenskaplike en spesialis op die gebied van eksperimentele patologie, 'n werk gepubliseer waarin hy demonstreer dat konyne wat gevoed is met cholesterolryke voedsel skade aan bloedvate opdoen wat lyk soos aterosklerotiese gedenkplate in die vate van bejaardes. Anichkov het sy dekades lank navorsing gedoen en die resultate in bekende Westerse tydskrifte gepubliseer. Ongelukkig het sy gegewens nie die basis gevorm vir 'n model vir die ontwikkeling van aterosklerose by mense nie, aangesien die hipotese destyds geheers het dat hierdie siekte 'n natuurlike gevolg van veroudering is en nie voorkom kan word nie. Bewyse het egter geleidelik opgebou oor die verband tussen serumcholesterol en die ontwikkeling van aterosklerose (lipiedhipotese) en in die 1960's. sommige navorsers het uitdruklik gesê dat hierdie siekte met medikasie behandel kan word. Die teenoorgestelde standpunt het egter bestaan tot die publikasie in 1984 van die resultate van 'n breë studie van die rol van cholesterol wat deur die Amerikaanse Nasionale Instituut vir Gesondheid (Coronary Primary Prevention Trial) uitgevoer is. 'N Statisties beduidende afname in die frekwensie van miokardiale infarksie en beroertes met 'n afname in bloedcholesterol was aangetoon. In hierdie studie is cholesterol, 'n anioonuitruilhars wat galsure bind, gebruik om cholesterol te verlaag. Die resultate het die soeke na nuwe, kragtiger terapeutiese middels gestimuleer. Ek moet sê dat die twyfel oor die geldigheid van die hipotese in die wetenskaplike wêreld heeltemal verdwyn het met die koms van statiene in die laat 1980's - vroeë negentigerjare.
Die eerste statine is deur Akira Endo in Sankyo in Tokio ontdek. Endo het sy werk in 1976 gepubliseer, hoewel hy die probleem van cholesterolmetabolisme vir etlike jare behandel het. In 1971 het hy voorgestel dat cholesterol-sintese-remmers ook in die sampioenprodusente van antibiotika wat destyds bestudeer is, bevat. Vir etlike jare van intensiewe werk het hy meer as 6000 kulture van verskillende sampioene geanaliseer totdat hy tot 'n positiewe resultaat gekom het. Die resulterende verbinding word kompakte genoem. Hierdie stof het cholesterol by honde en ape laer gemaak. Hierdie studies het die aandag van Michael Brown en Joseph Goldstein van die Southwestern Medical School in Texas, getrek. Brown en Goldstein, saam met Endo, het 'n gesamentlike studie begin en sy data bevestig. Die belangrikste suksesse van die eerste kliniese proewe het farmaseutiese ondernemings by die ontwikkeling van hierdie nuwe medisyne betrek. By Merck het 'n span onder leiding van Alfred Alberts en Roy Wagelos 'n nuwe sifting van sampioenkulture geloods en, as gevolg van die ontleding van 'n totaal van 18 kulture, 'n ander aktiewe middel ontdek. Die nuwe stof word lovastatien genoem. Terselfdertyd is daar egter algemeen geglo dat die toediening van hoë dosisse kompaktein aan honde lei tot die ontwikkeling van kanker en die soeke na nuwe statiene in die 1980's. geskors is. Teen daardie tyd was die voordele verbonde aan die gebruik van statiene om pasiënte met familiële hipercholesterolemie te behandel egter reeds sigbaar. Na talle konsultasies met internasionale kundiges en die Food and Drug Administration (FDA, VSA), het Merck begin met die ontwikkeling van lovastatin. Uitgebreide studies oor die volgende twee dekades het nie die karsinogene effek van lovastatien en die nuwe generasie medisyne wat daarna verskyn het, onthul nie.
Fig. 1. Statiene is remmers van NM G-CoA reduktase. Vergelyking van die struktuur van mevalonaat en vier farmaseutiese produkte (statiene) wat die werking van NM G-COA-reduktase belemmer.

statins die werking van HMG - CoA - reduktase belemmer, die struktuur van mevalonaat naboots en sodoende die sintese van cholesterol blokkeer. By pasiënte met hipercholesterolemie, wat veroorsaak word deur 'n defek in een kopie van die LDL-reseptore, word die cholesterolvlakke met 30% verminder tydens die inname van lovastatien. Die middel is selfs meer effektief in kombinasie met spesiale harsen wat galsure bind en die omgekeerde opname daarvan in die ingewande voorkom.
Op die oomblik word statiene meestal gebruik om die cholesterol in bloedplasma te verlaag. As u medikasie neem, ontstaan die vraag oor die ongewenste newe-effekte. In die geval van statiene is daar egter baie newe-effekte positief. Hierdie middels kan bloedvloei stimuleer, reeds bestaande aterosklerotiese gedeeltes regmaak (sodat dit nie van die wande van bloedvate wegbreek en nie die bloedvloei belemmer nie), die samesmelting van plaatjies belemmer, en ook inflammatoriese prosesse in die wande van bloedvate verswak. By pasiënte wat vir die eerste keer statiene neem, word hierdie effekte gemanifesteer nog voordat die cholesterolvlakke begin daal, en is dit moontlik geassosieer met die remming van isoprenoïede sintese. Natuurlik is nie alle newe-effekte van statiene voordelig nie. In sommige pasiënte (gewoonlik onder diegene wat statiene neem in kombinasie met ander middels wat cholesterol verlaag), kan spierpyn en spierswakheid voorkom, en soms in 'n redelike sterk vorm. Ander taamlike newe-effekte van statiene word ook geregistreer, wat gelukkig selde voorkom. By die oorgrote meerderheid van die pasiënte kan die neem van statiene die ontwikkeling van kardiovaskulêre siektes belemmer. Soos met enige ander medikasie, moet statiene slegs gebruik word soos aanbeveel deur u dokter.

Met 'n oorerflike afwesigheid van HDL-cholesterol, is cholesterolvlakke baie laag, en met Tanger-siekte word cholesterol prakties nie bepaal nie. Albei genetiese afwykings spruit uit mutasies in ABC1-proteïen. Die HDL-vrye cholesterolfraksie kan nie cholesterol in die selle met ABC1 vang nie, en die selle met cholesterol-uitputting word vinnig uit die bloed verwyder en vernietig. Beide die oorerflike afwesigheid van HDL- en Tanger-siekte is baie skaars (minder as 100 gesinne met Tanger-siektes is wêreldwyd bekend), maar hierdie siektes toon die rol van ABC1-proteïen in die regulering van HDL-plasmavlakke. Aangesien lae HDL-vlakke in plasma ooreenstem met 'n hoë tempo van koronêre arteriële skade, kan ABC1-proteïen 'n nuttige teiken wees vir medisyne wat ontwerp is om HDL-vlakke te reguleer. ■
Steroïedhormone word gevorm deur die syketting van cholesterol en die oksidasie daarvan te verdeel.
'N Persoon kry al sy steroïedhormone van cholesterol (Fig. 21-45). Twee klasse steroïedhormone word in die bynierskors gesintetiseer: mineralkortikoidy,wat die absorpsie van anorganiese ione (Na +, C1 - en HCO) reguleer 3 -) in die niere, en glukokortikoïede, wat help om glukoneogenese te reguleer en die inflammatoriese respons te verminder. Geslagshormone word in die voortplantingselle van mans en vroue en in die plasenta geproduseer. Onder hulle progesteroon, wat die vroulike voortplantingsiklus reguleer, androgene (bv. testosteroon) en oestrogenen (estradiol), wat die ontwikkeling van sekondêre seksuele eienskappe by mans en vroue respektiewelik beïnvloed. Steroïedhormone het 'n effek op baie lae konsentrasies en word daarom in relatiewe klein hoeveelhede gesintetiseer. In vergelyking met galsoute word relatief min cholesterol verbruik vir die produksie van steroïedhormone.

Fig. 21-45. Sommige steroïedhormone word gevorm deur cholesterol. Die strukture van sommige van hierdie verbindings word in Fig. 10-19, vers 1.

Die sintese van steroïedhormone benodig die verwydering van verskeie of al die koolstofatome in die 'syketting' van die C-17 D-ring van cholesterol. Die verwydering van die ketting vind plaas in die mitochondria van steroïdogene weefsels. Die verwyderingsproses bestaan uit hidroksilering van twee aangrensende koolstofatome van die syketting (C-20 en C-22), en dan die splitsing van die binding tussen hulle (Fig. 21-46). Die vorming van verskillende hormone sluit ook die toevoeging van suurstofatome in. Alle hidroksilering en oksidasie reaksies tydens steroïde biosintese word gekataliseer deur oksidase met gemengde funksie (add. 21-1) wat gebruik maak van NА D PH, O 2 en mitochondriale sitochroom P-450.
Fig. 21-46. Splyting van die syketting in die sintese van steroïedhormone. In hierdie oksidase-stelsel met 'n gemengde funksie wat aangrensende koolstofatome oksideer, dien sitochroom P-450 as 'n elektrondraer. Elektronentransporterende proteïene, adrenodoksien en adrenodoksienreduktase is ook betrokke by die proses. Hierdie stelsel van sykettingverdeling is gevind in mitochondria van die bynierskors, waar aktiewe produksie van steroïede plaasvind. Pregnenolone is 'n voorloper vir alle ander steroïedhormone (Fig. 21-45).

Cholesterolbiosintese-tussenprodukte is betrokke by baie ander metaboliese weë.
Benewens die rol daarvan as 'n tussenproduk van cholesterolbiosintese, dien isopentenielpyrofosfaat as 'n geaktiveerde voorloper in die sintese van 'n groot aantal biomolekules wat verskillende biologiese funksies verrig (Fig. 21-47). Dit sluit vitamiene A, E en K in, plantpigmente soos karoteen en die chlorofil fitol-ketting, natuurlike rubber, baie essensiële olies (byvoorbeeld die geurige basis van suurlemoenolie, eucalyptus, muskus), jong insekhormoon wat metamorfose reguleer, dolichols, wat dien as lipiedoplosbare draers in die komplekse sintese van polisakkariede, ubikinon en plastokkinon - elektrondraers in mitochondria en chloroplaste. Al hierdie molekules is isoprenoïede in struktuur. Meer as 20.000 verskillende isoprenoïede word in die natuur aangetref, en elke jaar word honderde nuwes aangemeld.
Fig. 21-47. Die geheelbeeld van die biosintese van isoprenoïede. Die strukture van die meeste eindprodukte wat hier aangebied word, word in hfst. 10 (vers 1).

Prenylering (kovalente aanhegting van 'n isoprenoïed, sien Fig. 27-35) is 'n algemene meganisme waardeur proteïene anker op die binneste oppervlak van soogdiere-selmembrane (sien Fig. 11-14). In sommige proteïene word die gebonde lipied voorgestel deur 'n 15-koolstof farnesielgroep, in ander is dit 'n 20-koolstof geranyl geranyl-groep. Hierdie twee soorte lipiede heg verskillende ensieme aan. Dit is moontlik dat prenyleringsreaksies proteïene na verskillende membrane rig, afhangende van watter lipied daaraan geheg is. Prilinasie van proteïene is 'n ander belangrike rol vir isopreen-afgeleides - deelnemers aan die metaboliese metaboliese weg.
Opsomming van Afdeling 21.4 Biosintese van cholesterol, steroïede en isoprenoïede
■ Cholesterol word gevorm deur asetiel-CoA in 'n komplekse reaksiesekwensie deur middel van ß-hidroksy-ß-metielglutaryl-CoA, mevalonaat, twee geaktiveerde isopreen dimetylallyl pyrofosfaat en isopenteniel pyrofosfaat. Die kondensasie van isopreeneenhede gee nie-sikliese squaleen, wat fietsry om 'n gekondenseerde ringstelsel en 'n steroïede syketting te vorm.
■ Die sintese van cholesterol is onder hormonale beheer en word verder belemmer deur toenemende konsentrasies van intrasellulêre cholesterol, wat plaasvind deur kovalente modifikasie en regulering van transkripsie.
■ Kolesterol- en cholesterolesters word deur die bloed as plasmalipoproteïene vervoer. Die VLDL-fraksie dra cholesterol, cholesterolesters en triasielglycerole van die lewer na ander weefsels oor, waar die triasielglycerole deur lipoproteïne lipase gekloof word en VLDL omgeskakel word na LDL. Die LDL-fraksie wat verryk is in cholesterol- en cholesterolesters word indirek deur reseptore vasgevang deur endositose, terwyl die B-100 apolipoproteïne in LDL deur plasma-membraanreseptore erken word. HDL verwyder cholesterol uit die bloed en dra dit na die lewer oor. Voedingstoestande of genetiese afwykings in cholesterolmetabolisme kan lei tot aterosklerose en miokardiale infarksie.
■ Steroïedhormone (glukokortikoïede, mineralokortikoïede en geslagshormone) word gevorm deur cholesterol deur die syketting te verander en suurstofatome in die steroïde stelsel van die ringe in te voer. Baie ander isoprenoïedverbindings word van mevalonaat vervaardig deur kondensasie van isopentenielpyrofosfaat en dimetielallyl pyrofosfaat saam met cholesterol.
■ Prenilering van sekere proteïene lei hulle na bindingsplekke met selmembrane en is belangrik vir hul biologiese aktiwiteit.
Vraag 48. Regulering van die metabolisme van hoë vetsure (ß-oksidasie en biosintese). Sintese van maloniel CoA. Asetiel CoA-karboksilase, regulering van die aktiwiteit daarvan. Vervoer van asiel Co-a deur die binneste membraan van mitochondria.
hoof
die hoeveelheid fenielalanien word verbruik
op twee maniere:
skakel aan
in eekhorings,
bekeerde
in tyrosien.
transformasie
fenielalanien tot tyrosien hoofsaaklik
nodig om oortollige te verwyder
fenielalanien, aangesien hoë konsentrasies
Dit is giftig vir selle. vorming
tyrosine maak nie regtig saak nie
sedert die gebrek aan hierdie aminosuur
in selle gebeur prakties nie.
primêre
fenielalanien metabolisme begin
met sy hidroksilering (Fig. 9-29), in
wat tirosien tot gevolg het.
Hierdie reaksie word gekataliseer deur 'n spesifieke
monoxyxy-nase - fenielalanien hydra (zsilase,
wat dien as medeprodusent
tetrahydrobiopterin (N4BP).
Ensiemaktiwiteit hang ook daarvan af
die teenwoordigheid van Fe2.
die
die lewer is hoofsaaklik versnelde mobilisering
glikogeen (sien afdeling 7). Maar aandele
glykogeen in die lewer is verby
18-24 uur vas. Hoofbron
glukose soos die voorraad opraak
glikogeen word glukoneogenese,
wat begin versnel
Fig.
11-29. Groot metaboliese veranderinge
energie wanneer u absorber verander
postabsorberende toestand. CT
- ketoonliggame, FA - vetsure.
4-6 uur
na die laaste maaltyd. substrate
gliserol word gebruik vir glukose-sintese,
aminosure en laktaat. Hoog
glukagon konsentrasie sintese tempo
vetsure verminder as gevolg van
fosforilering en inaktivering
asetiel CoA-karboksilase en tempo
p-oksidasie neem toe. Terselfdertyd
verhoogde vettoevoer na die lewer
sure wat vervoer word
van vet depots. Asetiel-CoA gevorm
in die oksidasie van vetsure word dit gebruik
in die lewer vir die sintese van ketonliggame.
die
vetweefsel met toenemende konsentrasie
glukagon verminder sintesetempo
TAG en lipolise word gestimuleer. stimulasie
lipolise - aktiveringsresultaat
hormoon-sensitiewe TAG-lipase
adiposiete onder invloed van glukagon.
Vetsure word belangrik
energiebronne in die lewer, spiere en
vetweefsel.
daarom
dus in die postabsorpsie periode
bloedglukosekonsentrasie word gehandhaaf
op die vlak van 80-100 mg / dl, en die vetvlak
sure en ketoonliggame neem toe.
suiker
diabetes is 'n siekte wat voorkom
as gevolg van absoluut of relatief
insulien tekort.
A.
Die belangrikste kliniese vorme van suiker
diabetes
Volgens
Wêreldorganisasie
gesondheidsorg diabetes
geklassifiseer volgens verskille
genetiese faktore en kliniese
twee hoofvorme: diabetes
Tipe I - insulienafhanklike (IDDM) en diabetes
Tipe II - nie-insulienafhanklik (NIDDM).
regulasie
sintese van zhk Regulerende ensiem
sintese van lcd - asetiel CoA-karboksilase.
Hierdie ensiem word deur verskeie gereguleer
maniere.
Aktivering / dissosiasie
ensiem-subeenheidskomplekse. die
onaktiewe vorm van asetiel CoA-karboksilase
stel verskillende komplekse voor,
elk bestaan uit 4 subeenhede.
Die aktiveerder van die ensiem is sitraat. Dit stimuleer
kombinasie van komplekse, as gevolg daarvan
waardeur ensiemaktiwiteit toeneem
. Inhibeerder-palmitoyl-KoA. Hy bel
ingewikkelde dissosiasie en afname
ensiemaktiwiteit.
Fosforylering / Dephosforylering
asetiel CoA-karboksilase. die
postabsorpsietoestand of in
fisiese werk glukagoniseer
adrenalien deur adenilaat siklas
die stelsel word geaktiveer deur prokinase A en
stimuleer subeenheid fosforilering
asetiel CoA-karboksilase. gefosforileerde
die ensiem is onaktief en die sintese van vetterig
sure stop.
die absorberende
periode insulien aktiveer fosfatase,
en asetiel-CoA-karboksilase gaan in
gedefosforyleerde toestand. dan
onder die invloed van sitraat voorkom
polimerisasie van die protomere van die ensiem, en
hy raak aktief. Benewens aktivering
ensiem, sitraat voer 'n ander uit
funksie in die sintese van LCD. die absorberende
periode in die mitochondria van lewerselle
sitraat ophoop, waarin
die asielresidu word vervoer na
sitosol.
regulasie
β-oksidasietempo's.
Β oksidasie-metaboliese weg,
stewig gekoppel aan die werk van die CPE en die algemeen
maniere van katabolisme. Daarom is dit vinnig
gereguleer deur selbehoefte vir
energie d.w.s. volgens die verhoudings van ATP / ADP en NADH / NAD, sowel as die reaksietempo van CPE en
algemene weg van katabolisme. spoed
ß-oksidasie in weefsels hang af van beskikbaarheid
substraat, d.w.s.
op die hoeveelheid vetterige
sure wat die mitochondria binnedring.
Gratis vetsuurkonsentrasie
in die bloed styg by aktivering
lipolise in vetweefsel tydens vas
onder invloed van glukagon en tydens fisiese
werk onder die invloed van adrenalien. In hierdie
vetsure word
oorheersende energiebron
as gevolg van spiere en lewer
ß-oksidasies word gevorm deur NADH en asetiel-CoA-remming
pirovaatdehidrogenase-kompleks.
Transformasie van pirovaatvorming
van glukose tot asetiel-CoA vertraag.
Intermediêre metaboliete versamel
glikolise en veral glukose-6-fosfaat.
Glukose-6-fosfaat belemmer heksokinase
en ontmoedig daarom
die gebruik van glukose in die proses
glikolise. Daarom is die oorheersende
gebruik van lcd as die hoofbron
energie in spierweefsel en lewer
spaar glukose vir senuwee weefsel en
rooibloedselle.
Β oksidasie snelheid
hang af van ensiemaktiwiteit
karnitien asieltransferases I.
In die lewer word hierdie ensiem geïnhibeer.
malonyl CoA, 'n stof wat gevorm word
met biosintese van lcd. In die absorpsietydperk
glikolise word in die lewer en
vorming van asetiel-CoA neem toe
van pirovaat. Eerste sintesiereaksie
lcd omskakeling van asetiel-CoA na malonyl-CoA.
Malonyl-CoA inhibeer die ß-oksidasie van lcd,
wat vir sintese gebruik kan word
vet.
vorming
maloniel-CoA van asetiel-CoA-regulatories
reaksie in biosintese lcd. Eerste reaksie
sintese lcd omskakeling van asetiel-CoA na
malonyl CoA. Katalitiese ensiem
hierdie reaksie (asetiel Coa-karboksilase),
behoort tot die klas ligases. Hy bevat
kovalent gebonde biotien. In die eerste
ko2 kovalente reaksiestadia
bind aan biotien as gevolg van energie
ATP, in fase 2 COO- oorgedra
op asetiel-CoA om maloniel-CoA te vorm.
Asetiel CoA-karboksilase-ensiemaktiwiteit
bepaal die spoed van alle daaropvolgende
sintese reaksies lc
sitraat aktiveer 'n ensiem in sitosol
asetiel CoA-karboksilase. Malonyl CoA in
op sy beurt belemmer die oordrag van hoër
vetsure van sitosol tot matriks
mitochondria-remmende aktiwiteit
eksterne asetiel CoA: karnitien asieltransferase,
en sodoende die oksidasie van hoër afskakel
vetsure.
Asetiel-CoA-oksaloasetaat →
HS-CoA Citrate

HSCOA ATP Citraat → Asetiel-CoA ADP Pi Oxaloacetate
Asetiel-KoA
in die sitoplasma dien as die beginnersubstraat
vir die sintese van lcd, en oxaloacetate in
sitosol ondergaan transformasies in
die resultaat waarvan pirovaat gevorm word.
Cholesterolbiosintese
Cholesterolbiosintese kom voor in die endoplasmiese retikulum. Die bron van alle koolstofatome in die molekule is asetiel-SCoA, wat hier kom uit mitochondria as deel van sitraat, soos in die sintese van vetsure. Die cholesterolbiosintese verbruik 18 ATP-molekules en 13 NADPH-molekules.
Die vorming van cholesterol kom voor in meer as 30 reaksies, wat in verskillende fases gegroepeer kan word.
1. Sintese van mevalonzuur.
Die eerste twee sintesereaksies val saam met die ketogenesereaksies, maar na die sintese van 3-hidroksy-3-metielglutaryl-ScoA, gaan die ensiem binne hidroksimetiel-glutaryl-ScoA-reduktase (HMG-SCOA-reduktase), wat mevalonzuur vorm.
 |