Die volgorde van cholesterolsintese in die lewer
Die transformasie van lanosterol in cholesterol word in die membrane van die endoplasmatiese hepatosiet retikulum uitgevoer. 'N Dubbele binding vorm in die molekule van die eerste verbinding. Hierdie reaksie verbruik baie energie deur NADPH as skenker te gebruik. Na die invloed van verskillende transformatorensieme op lanosterol, verskyn cholesterol.
Vervoer Q10
'N Belangrike funksie van cholesterol is ook Q10-oordrag. Hierdie verbinding is verantwoordelik vir die beskerming van die membraan teen die negatiewe gevolge van ensieme. 'N Groot aantal van hierdie verbindings word in sommige strukture geproduseer en kom eers in die bloedstroom. Hy het nie die vermoë om onafhanklik in die oorblywende selle in te dring nie, en daarom het hy 'n draer nodig. Cholesterol hanteer hierdie taak suksesvol.
Basiese verbindingsfunksies
Soos hierbo genoem, kan hierdie stof nuttig wees vir mense, natuurlik net as ons van HDL praat.
Op grond hiervan word dit duidelik dat die stelling dat cholesterol absoluut skadelik vir mense is, 'n fout is.
Cholesterol is 'n biologies aktiewe komponent:
- neem deel aan die sintese van geslagshormone,
- verseker die normale werking van serotonienreseptore in die brein,
- is die belangrikste bestanddeel van gal, sowel as vitamien D, wat verantwoordelik is vir die opname van vette,
- voorkom die vernietiging van die intrasellulêre strukture onder die invloed van vrye radikale.
Maar saam met die positiewe eienskappe, kan die stof die menslike gesondheid benadeel. Byvoorbeeld, LDL kan die ontwikkeling van ernstige siektes veroorsaak, veral bydra tot die ontwikkeling van aterosklerose.
In die lewer word die biokomponent gesintetiseer onder invloed van HMG-redutase. Dit is die belangrikste ensiem wat betrokke is by biosintese. Inhibisie van sintese vind plaas onder die invloed van negatiewe terugvoer.
Die sinteseproses van 'n stof in die lewer het 'n omgekeerde verband met die dosis van 'n verbinding wat die menslike liggaam met voedsel binnedring.
Hierdie proses word nog eenvoudiger beskryf. Die lewer reguleer onafhanklik cholesterolvlakke. Hoe meer 'n persoon voedsel bevat wat hierdie bestanddeel bevat, hoe minder stof word in die selle van die orgaan geproduseer, en as ons in ag neem dat vette saam met produkte wat dit bevat, verbruik word, is hierdie reguleringsproses baie belangrik.
Kenmerke van die sintese van materie
Normale gesonde volwassenes sintetiseer HDL teen 'n dosis van ongeveer 1 g / dag en verbruik ongeveer 0,3 g / dag.
 'N Relatiewe konstante vlak van cholesterol in die bloed het so 'n waarde - 150-200 mg / dl. Word hoofsaaklik gehandhaaf deur die vlak van sintese van denovo te beheer.
'N Relatiewe konstante vlak van cholesterol in die bloed het so 'n waarde - 150-200 mg / dl. Word hoofsaaklik gehandhaaf deur die vlak van sintese van denovo te beheer.
Dit is belangrik om daarop te let dat die sintese van HDL en LDL van endogene oorsprong gedeeltelik deur die dieet gereguleer word.
Cholesterol, beide van voedsel en gesintetiseer in die lewer, word gebruik in die vorming van membrane in die sintese van steroïedhormone en galsure. Die grootste deel van die stof word in die sintese van galsure gebruik.
Die inname van HDL en LDL deur selle word deur drie verskillende meganismes op 'n konstante vlak gehandhaaf:
- Regulering van HMGR-aktiwiteit
- Regulering van oortollige intrasellulêre vrye cholesterol deur die aktiwiteit van O-asieltransferase sterol, SOAT1 en SOAT2 met SOAT2, wat die oorwegend aktiewe komponent in die lewer is. Die aanvanklike benaming vir hierdie ensieme was ACAT vir asiel-CoA: asieltransferase-cholesterol. Ensieme ACAT, ACAT1 en ACAT2 is asetiel CoA asetieltransferases 1 en 2.
- Deur plasma-cholesterolvlakke te beheer via LDL-bemiddelde opname van die reseptor en HDL-bemiddelde omgekeerde vervoer.
Die regulering van HMGR-aktiwiteit is die belangrikste manier om die vlak van biosintese van LDL en HDL te beheer.
Die ensiem word beheer deur vier verskillende meganismes:
- terugvoerinhibisie,
- geenuitdrukking beheer,
- enzymafbrekingstempo,
- fosforilering-defosforilasie.
Die eerste drie beheermeganismes werk direk op die stof self. Cholesterol dien as 'n remmer van terugvoer van die bestaande HMGR, en veroorsaak ook vinnige agteruitgang van die ensiem. Laasgenoemde is die resultaat van die polyubiquitinering van HMGR en die afbraak daarvan in die proteosoom. Hierdie vermoë is 'n gevolg van die sterol-sensitiewe domein van HMGR SSD.
Boonop neem die hoeveelheid mRNA vir HMGR af as die cholesterol te veel is as gevolg van 'n verminderde geenuitdrukking.
Ensieme betrokke by die sintese
 As die eksogene komponent deur kovalente modifikasie gereguleer word, sal hierdie proses uitgevoer word as gevolg van fosforilering en defosforilering.
As die eksogene komponent deur kovalente modifikasie gereguleer word, sal hierdie proses uitgevoer word as gevolg van fosforilering en defosforilering.
Die ensiem is die mees aktiewe in ongemodifiseerde vorm. Fosforylering van die ensiem verminder die aktiwiteit daarvan.
HMGR word gefosforileer deur AMP-geaktiveerde proteïenkinase, AMPK. AMPK word self deur fosforilering geaktiveer.
AMPK-fosforylering word gekataliseer deur ten minste twee ensieme, naamlik:
- Die primêre kinase wat verantwoordelik is vir AMPK-aktivering is LKB1 (lewerkinase B1). LKB1 is die eerste keer geïdentifiseer as 'n geen by mense wat 'n outosomale dominante mutasie in die Putz-Jegers-sindroom, PJS, dra. Daar is ook bevind dat LKB1 mutant is in longadenokarsinoom.
- Die tweede fosforylerende ensiem AMPK is kalmodulienafhanklike proteïenkinase kinase beta (CaMKKβ). CaMKKβ induseer AMPK fosforilering as reaksie op 'n toename in intrasellulêre Ca2 + as gevolg van spiersametrekking.
Die regulering van HMGR deur kovalente modifikasie laat toe dat HDL geproduseer word. HMGR is die aktiefste in die gedefosforyleerde toestand. Fosforilering (Ser872) word gekataliseer deur AMP-geaktiveerde proteïenkinase (AMPK) ensiem, waarvan die aktiwiteit ook deur fosforilering gereguleer word.
AMPK-fosforilering kan voorkom as gevolg van ten minste twee ensieme:
Dephosforylering van HMGR word teruggevoer na 'n meer aktiewe toestand deur die werking van proteïenfosfatases van die 2A-familie. Met hierdie reeks kan u die produksie van HDL beheer.
Wat beïnvloed die tipe cholesterol?
 Funksionele PP2A bestaan in twee verskillende katalitiese isoforme wat gekodeer word deur twee gene wat geïdentifiseer is as PPP2CA en PPP2CB. Die twee belangrikste isoforme van PP2A is die heterodimeriese kernensiem en die heterotrimeriese holoensiem.
Funksionele PP2A bestaan in twee verskillende katalitiese isoforme wat gekodeer word deur twee gene wat geïdentifiseer is as PPP2CA en PPP2CB. Die twee belangrikste isoforme van PP2A is die heterodimeriese kernensiem en die heterotrimeriese holoensiem.
Die belangrikste ensiem PP2A bestaan uit 'n steier substraat (oorspronklik 'n subeenheid genoem) en 'n katalitiese subeenheid (C-subeenheid). Die katalitiese α-subeenheid word deur die PPP2CA-geen gekodeer, en die katalitiese β-subeenheid word deur die PPP2CB-geen gekodeer.
Die onderbou van die α-steier word gekodeer deur die PPP2R1A-geen en die β-subeenheid van die PPP2R1B-geen. Die belangrikste ensiem, PP2A, is in wisselwerking met 'n veranderlike regulerende subeenheid om in 'n holo-ensiem te vergader.
Die PP2A-kontroleenhede bevat vier families (oorspronklik B-subeenhede genoem), wat elk bestaan uit verskillende isoforme wat deur verskillende gene gekodeer word.
Daar is tans 15 verskillende gene vir die regulerende subeenheid van PP2A B. Die belangrikste funksie van die regulerende subeenhede van PP2A is om die gefosforyleerde substraatproteïene op die fosfatase-aktiwiteit van die katalitiese subeenhede van PP2A te rig.
PPP2R is een van 15 verskillende regulatoriese subeenhede van PP2A. Hormone soos glukagon en adrenalien beïnvloed cholesterolbiosintese nadelig deur die aktiwiteit van spesifieke regulatoriese subeenhede van PP2A-familieensieme te verhoog.
PKA-gemedieerde fosforylering van die regulerende subeenheid van PP2A (PPP2R) lei tot die vrystelling van PP2A uit HMGR, wat die defosforylering daarvan voorkom. Deur die effekte van glukagon en adrenalien teë te werk, stimuleer insulien die verwydering van fosfate en verhoog dit die aktiwiteit van HMGR.
Bykomende regulering van HMGR vind plaas deur remming van terugvoer met cholesterol, sowel as die regulering van die sintese daarvan deur die verhoging van die intracellulêre cholesterol en sterol.
Laasgenoemde verskynsel word geassosieer met die transkripsiefaktor SREBP.
Hoe is die proses in die menslike liggaam?
 HMGR-aktiwiteit word addisioneel gemonitor deur seine met AMP. 'N Toename in cAMP aktiveer 'n cAMP-afhanklike proteïenkinase, PKA. In die konteks van HMGR-regulering fosforileer PKA die regulatoriese subeenheid, wat lei tot 'n toename in die vrystelling van PP2A vanaf HMGR. Dit verhoed dat PP2A fosfate uit die HMGR verwyder, en die heraktivering daarvan voorkom.
HMGR-aktiwiteit word addisioneel gemonitor deur seine met AMP. 'N Toename in cAMP aktiveer 'n cAMP-afhanklike proteïenkinase, PKA. In die konteks van HMGR-regulering fosforileer PKA die regulatoriese subeenheid, wat lei tot 'n toename in die vrystelling van PP2A vanaf HMGR. Dit verhoed dat PP2A fosfate uit die HMGR verwyder, en die heraktivering daarvan voorkom.
'N Groot familie regulerende proteïenfosfatase-eenhede reguleer en / of inhibeer die aktiwiteit van talle fosfatases, insluitend lede van die PP1, PP2A en PP2C families. Benewens PP2A-fosfatases wat fosfate uit AMPK en HMGR verwyder, verwyder fosfatases van die proteïenfosfatase 2C-familie (PP2C) ook fosfate uit AMPK.
Wanneer hierdie regulatoriese subeenhede PKA fosforileer, neem die aktiwiteit van gebonde fosfatases af, wat veroorsaak dat AMPK in die gefosforyleerde en aktiewe toestand bly, en HMGR in die gefosforyleerde en onaktiewe toestand. Namate die stimulus verwyder word, wat lei tot 'n toename in die produksie van cAMP, daal die fosforylasievlak en neem die de-fosforylasievlak toe. Die eindresultaat is 'n terugkeer na 'n hoër vlak van HMGR-aktiwiteit. Aan die ander kant lei insulien tot 'n afname in cAMP, wat op sy beurt die sintese aktiveer. Die eindresultaat is 'n terugkeer na 'n hoër vlak van HMGR-aktiwiteit.
Aan die ander kant lei insulien tot 'n afname in cAMP, wat op sy beurt die cholesterol sintese aktiveer. Die eindresultaat is 'n terugkeer na 'n hoër vlak van HMGR-aktiwiteit. Insulien lei tot 'n afname in cAMP, wat op sy beurt weer gebruik kan word om die sinteseproses te verbeter.
Die vermoë om insulien te stimuleer en glukagon te rem, HMGR-aktiwiteit stem ooreen met die invloed van hierdie hormone op ander metaboliese metaboliese prosesse. Die belangrikste funksie van hierdie twee hormone is om toeganklikheid te beheer en energie na alle selle te vervoer.
Langtermynmonitering van HMGR-aktiwiteit word hoofsaaklik uitgevoer deur die sintese en afbraak van die ensiem te beheer. Wanneer cholesterolvlakke hoog is, daal die vlak van HMGR-geenuitdrukking, en omgekeerd aktiveer laer vlakke geenuitdrukking.
Inligting oor cholesterol word in die video in hierdie artikel verskaf.
Wat is die kern van die produksie van cholesterolmolekules?
Baie voedsel vul die liggaam met cholesterol - dit is produkte van dierlike oorsprong, sowel as transvette, wat in groot hoeveelhede in verwerkte voedsel, sowel as kitskos (kitskos) voorkom.
As u sulke produkte geweldig gebruik, sal die konsentrasie van cholesterolmolekules in die bloed hoog word en moet u 'n mediese oplossing vir hipercholesterolemie gebruik.
Cholesterol, wat voedsel in die liggaam binnedring, het 'n lae molekulêre digtheid, wat lei tot die afsetting van sulke cholesterol op die binnekant van bloedvate, wat die ontwikkeling van cholesterolplaak en die patologie van aterosklerose uitlok.
'N Toename in die cholesterolindeks in die bloed vind nie net plaas omdat dit van buite af kom nie, maar ook as gevolg van 'n oortreding in die proses om lipoproteïenmolekules deur lewerselle te sintetiseer.
 Cholesterol sintese tot inhoud ↑
Cholesterol sintese tot inhoud ↑
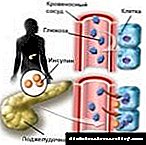
Sintese van cholesterol in die lewer
Die sintese van cholesterol in die liggaam is ongeveer 0,50-0,80 gram per dag.
Die sintese van cholesterolmolekules in die liggaam word versprei:
- 50.0% word deur lewerselle geproduseer,
- 15,0% - 20,0% - deur die departemente van die dunderm,
- 10.0% - word gesintetiseer deur die bynierskors en velselle.
Alle selle in die menslike liggaam het die vermoë om lipoproteïene te sintetiseer.
Met voedsel kom tot 20,0% van die totale totale cholesterolmolekule die liggaam binne - ongeveer 0,40 gram per dag.
Lipoproteïene word met behulp van galsuur buite die liggaam uitgeskei, en die gebruik van cholesterolmolekules per gal per dag is hoogstens 1,0 gram.
Die biosintese van lipoproteïene in die liggaam
Die biosintese van lipiedmolekules vind plaas in die endoplasmiese afdeling - die retikulum. Die basis vir alle atome van koolstofmolekules is die stof asetiel-SCoA, wat die mitopondras in die sitraatmolekules in die endoplasma binnedring.
Tydens die biosintese van lipoproteïenmolekules neem 18 ATP-molekules deel, en 13 NADPH-molekules neem deel aan die sintese.
Die proses van cholesterolvorming word deur minstens 30 stadiums en reaksies in die liggaam gedoen.
Die gefaseerde sintese van lipoproteïene kan in groepe verdeel word:
voeg aktiewe prompt - suiker vlak in
- Die sintese van mevalonzuur vind plaas tydens die ketogenese van die eerste twee reaksies, en na die derde fase reageer 3-hydroxy-3-methylglutaryl-ScoA met die HMG-ScoA reduktase molekule. Uit hierdie reaksie word Mevalonate gesintetiseer. Hierdie reaksie benodig voldoende hoeveelheid glukose in die bloed. U kan dit opmaak met behulp van soet kos en graan,
- Die sintese van isopentenyldifosfaat vind plaas na die toevoeging van fosfaat aan mevalonzuurmolekules en die ontwatering daarvan,
- Die sintese van farnesyldifosfaat vind plaas na die kombinasie van drie isopentenyldifosfaatmolekules,
- Squaleensintese is die binding van 2 molekules farnesyldifosfaat,
- Die reaksie van die oorgang van squaleen na die lanosterolmolekule vind plaas,
- Nadat onnodige metielgroepe verwyder is, word cholesterol omgeskakel.


Regulering van die sintese van lipoproteïene
Die regulerende element in die sinteseproses is die ensiem hydroxymethylglutaryl-ScoA reduktase. Die vermoë van hierdie ensiem om aktiwiteit te verander, is meer as 100 keer.
Die regulering van ensiemaktiwiteit geskied volgens verskillende beginsels:
- Regulering van sintese op metaboliese vlak. Hierdie beginsel werk "van die teenoorgestelde", die ensiem word deur cholesterol belemmer, wat dit moontlik maak om 'n konstante intrasellulêre inhoud te handhaaf,
- Kovalente hormonale regulering.
Regulering op hormonale vlak vind in die volgende stadiums plaas:
- 'N Toename in die hormooninsulien in die liggaam aktiveer proteïenfosfatase, wat 'n toename in die aktiwiteit van die hoofensiem HMG-ScoA-reduktase uitlok,
- Die hormoon glukagon en die hormoon adrenalien kan die element proteïenkinase A aktiveer, wat die ensiem HMG-ScoA-reduktase fosforileer en hul aktiwiteit verminder,
- Die aktiwiteit van cholesterol-sintese hang af van die konsentrasie van 'n spesiale transporterproteïen in die bloed, wat die intermediêre reaksies van metaboliete betyds bind.
Liggaamscholesterol
Die cholesterol wat in lewerselle gesintetiseer word, is nodig vir die liggaam vir verskillende belangrike prosesse:
- In elke selmembraan versterk cholesterolmolekules dit en maak dit elasties,
- Met behulp van lipoproteïene verhoog choroïed selle hul deurlaatbaarheid, wat hulle beskerm teen eksterne invloede,
- Sonder die hulp van lipoproteïene produseer die byniere nie die steroïed tipe geslagshormone nie,
- Met behulp van lipiede vind die vervaardiging van galsuur plaas en voorkom dit dat die galblaas daarin klipvorming vorm,
- Lipoproteïene bind neuronselle in die rugmurg en in die brein saam,
- Met behulp van lipoproteïene word die omhulsel van senuweevesels versterk,
- Met behulp van cholesterol vind die produksie van vitamien D plaas, wat help om kalsium op te neem en die vernietiging van beenweefsel voorkom.
Cholesterol help die byniere om hierdie groepe hormone te sintetiseer:
- Kortikosteroïedgroep
- Glukokortikoïedhormoongroep,
- Groep mineralokortikoïede.
 Cholesterol help om adrenale sintese van hormoongroepe te produseer
Cholesterol help om adrenale sintese van hormoongroepe te produseerHierdie hormone sorg vir die prosesse van hormonale regulering van menslike voortplantingsorgane.
Molekules van cholesterol na sintese in die lewerselle betree die endokriene orgaan van die bynier en dra by tot die produksie van hormone en handhaaf balans in die hormonale sfeer.
Metabolisme van vitamien D-molekules in die liggaam
Die produksie van vitamien D-molekules kom van sonlig, wat die cholesterol onder die vel binnedring. Op hierdie punt vind die sintese van vitamien D plaas, wat baie belangrik is vir die liggaam om kalsiumminerale op te neem.
Na sintese word alle soorte lipoproteïene deur die bloedstroomstelsel vervoer.
Vitamien D kan slegs deur lipoproteïne met 'n hoë molekulêre digtheid getransformeer word, en lipiede met 'n lae molekulêre gewig veroorsaak die ontwikkeling van aterosklerose-patologie, omdat dit die vermoë het om op die binnemembrane van die are te vestig in die vorm van cholesterolplaak, wat hierdie patologie laat groei en uitlok.
Soms kan cholesterolplaatjies by mense onder die vel op die hande waargeneem word.
 Vitamien D-metabolisme tot inhoud ↑
Vitamien D-metabolisme tot inhoud ↑
Versteurings in die sintese van lipoproteïene
In baie metaboliese prosesse in die liggaam kan mislukking en ontwrigting voorkom. Sulke afwykings kan voorkom in lipiedmetabolisme. Daar is baie redes en daar bestaan eksogene en endogene etiologie.
Endogene oorsake van lipoproteïensintese-afwykings sluit in:
- Die ouderdom van 'n persoon. Na 40 jaar in die menslike liggaam, verswak die produksie van geslagshormone en word die hormonale agtergrond versteur, en teen die ouderdom van 45 - 50 vertraag alle metaboliese prosesse, wat ook kan lei tot 'n afbraak in lipiedmetabolisme,
- Geslag - Mans is meer geneig tot ophoping van cholesterol as vroue. Vroue voor menopouse en menopouse word beskerm deur die produksie van geslagshormone, teen die ophoping van lipoproteïene,
- Genetiese oorerflike geneigdheid. Die ontwikkeling van familiële hipercholesterolemie.
Eksogene oorsake van lipiedversaking sluit faktore in wat afhang van die lewenstyl van die pasiënt, sowel as gepaardgaande patologieë wat bydra tot 'n skending in die sintese van cholesterolmolekules:
- Nikotienverslawing,
- Chroniese alkoholverslawing,
- Onbehoorlike voeding kan lei tot verhoogde cholesterol in die liggaam en die ophoping daarvan nie net in die bloed nie,
- 'N sittende leefstyl veroorsaak vertraagde metaboliese prosesse en lipoproteïensintese,
- Hipertensie - hoë druk in die bloedstroom gee voorvereistes dat die vaskulêre membrane versadig is met lipiedvette, wat dan 'n cholesterolplaak vorm,
- Dislipidemie is 'n versteuring in lipiedmetabolisme. Met patologie ontstaan daar 'n wanbalans tussen VP-lipoproteïene, NP-lipiede, sowel as die vlak van trigliseriede in die bloed,
- Patologie vetsug,
- Diabetes mellitus. Met hiperglykemie word metabolisme en lipiede metabolisme versteur.
 Patologie vetsugtot inhoud ↑
Patologie vetsugtot inhoud ↑Tekort aan voordelige cholesterolmolekules in die liggaam
Daar is patologieë wat die konsentrasie van hoë-molekulêre cholesterol in die bloed verminder as gevolg van 'n afname in die sintese van HDL-molekules.
Dit kan lei tot patologieë in die skildklier, dit kan die vlak van suiker in die bloed aansienlik beïnvloed en diabetes uitlok, asook baie siektes in die bloedstroom en hartorgaan veroorsaak.
Die gevolge van 'n lae konsentrasie cholesterol met 'n hoë molekulêre gewig kan die volgende wees:
- Die patologie van ragitis, wat ontwikkel in die kinderjare as gevolg van verminderde sintese van vitamien D en die verteerbaarheid van kalsiummolekules,
- Vroeë veroudering van liggaamselle. Sonder die spoedige verskaffing van cholesterol aan die selmembrane word dit vernietig en begin die verouderingsproses,
- 'N skerp afname in liggaamsgewig, wat ontstaan as gevolg van onvoldoende sintese van cholesterolmolekules, en 'n verswakte lipiedmetabolisme,
- Seerheid in spierweefsel weens 'n gebrek aan lipiedspierselle,
- Pyn in die hartorgaan wat 'n hartaanval kan veroorsaak.
U kan die cholesterolindeks met 'n hoë molekulêre gewig korrigeer met behulp van voedingsvoeding, wat seevis, verskillende plantaardige olies en suiwelprodukte insluit.
En moenie vergeet van vars vrugte, kruie en groente nie - dit moet die oorhand kry in die dieet.